
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:022
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.已知钒的原子序数为23,试回答下列问题:
(1)钒在元素周期表位于第________周期,第________族.
(2)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价).若用氧化物的形式表示,该化合物的化学式为________.
(3)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒.请配平下列反应的化学方程式:
________VO2++________H2C2O4→________VO++________CO2+________H2O
(4)工业上由V2O5冶炼金属钒常用铝热剂法.试用化学方程式表示出来:________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:022
(1)在热的稀硫酸溶液中溶解了11.4 g FeSO4.当加入50 mL 0.5 mol L-1 KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出.
□FeSO4+□KNO3+□H2SO4→K2SO4+□Fe2(SO4)3+□NxOy+□H2O
①推算出x=________,y=________.
②配平该化学方程式(系数填写在上式方框内)
③反应中氧化剂为________.
④用短线和箭头标出电子转移的方向和总数.
(2)油画所用颜料含有某种白色的铅化合物,置于空气中,天长日久就会生成黑色PbS,从而使油画的色彩变暗,若用H2O2来“清洗”,则可将PbS转变为白色的PbSO4而使油画“复原”.请填空:
①上述“清洗”反应的化学方程式为________.
②若有0.1 mol的PbS参加反应,则在此反应中发生转移的电子为________mol.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:022
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸.
(1)白磷是________晶体,31 g白磷与足量的氧气完全燃烧释放出745.5 kJ的热量,请写出白磷燃烧的热化学反应方程式:________;
(2)已知白磷和氯酸溶液可发生如下反应:
![]()
配平并完成上述反应方程式,该反应的氧化剂是________.
(3)白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:11P4+60CuSO4+96H2O![]() 20Cu3P+24H3PO4+60H2SO4
20Cu3P+24H3PO4+60H2SO4
该反应的氧化产物是________,若有1.1 mol P4反应,则有________mol电子转移.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:022
写出下列反应的化学方程式:
(1)Br2在加热的情况下跟氢氧化钠溶高考资源网液反应生成溴化钠、溴酸钠(NaBrO3)和水,化学方程式为:________.
(2)氯胺(NH2Cl)在中性或酸性条件下是一种强消毒杀菌剂,常用于城市自来水杀毒.根据水解原理你认为主要发生的化学反应方程式为:________.
(3)氯酸是一种强酸,当氯酸溶液中氯酸的质量分数超过40%时,它会迅速分解,产生一种比它酸性更强的酸,同时放出a,b两种气体,其中a能使余烬的木条复燃;b能使润湿的碘化钾试纸变蓝;而且a与b的物质的量之比为15∶8.根据以上事实写出氯酸分解的化学反应方程式:________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:022
(1)配平下列离子反应方程式:
________Fe(OH)3+________ClO-+________OH-![]() ________FeO4n-+________Cl-+________H2O
________FeO4n-+________Cl-+________H2O
(2)已知有3.21 g Fe(OH)3参加反应,共转移了5.4×1022个电子,则n=________,FeO4n-中铁元素的化合价为________.
(3)根据(1)、(2)推测,FeO4n-能和下列________(填序号)物质反应.
A.KMnO4 B.SO2 C.H2S D.O2
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:022
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应生成MnSO4、K2SO4、H2O和O2
(1)写出该氧化还原反应的化学方程式:________.
(2)反应中氧化剂是________;被氧化的元素是________;若有0.5 mol H2O2参加此反应,电子转移个数为________.
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:________;这时若有0.5 mol H2O2发生分解,电子转移个数为________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-物质结构与性质(2) 题型:022
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
(1)第四周期过渡元素的明显特征是形成多种多样的配合物.
①CO可以和很多过渡金属形成配合物.CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为________,CO分子里的共价键有________.
②金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,它在423K就分解为Ni和CO,从而制得高纯度的Ni粉.Ni(CO)4易溶于下列________.
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.
镓的基态电子排布式是________.
31
Ga的第一电离能却明显低于30Zn,原因是________.查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-物质结构与性质(2) 题型:022
(1)Ⅰ.短周期某主族
元素M的电离能情况如图(A)所示.则M元素位于周期表的第________族.
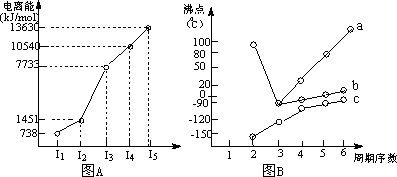
Ⅱ.图B折线c可以表达出第________族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:________(填“a”或“b”);部分有机物的熔沸点见下表:

由这些数据你能得出的结论是(至少写2条):________,________.
(2)COCl2俗称光气,分子中C原子采取________杂化成键;其中碳氧原子之间共价键含有________(填字母):a.2个σ键;b.2个π键;c.1个σ键、1个π键.
(3)金属是钛(22Ti)将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为________;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的2/3.则绿色晶体配合物的化学式为________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-物质结构与性质(2) 题型:022
下表列出前20号元素中的某些元素性质的一些数据:

试回答下列问题:
(1)以上10种元素中,第一电离能最小的是________(填编号)
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是________(写分子式).元素⑨和⑩形成的化合物的化学式为________,它是一种重要的结构材料,推测它应是属于________晶体;元素①的原子价电子排布式是________.
(3)元素③有一种单质为O3,其分子呈V形结构,键角116.5.三个原子以一个为中心,与另外两个原子分别构成一个非极性键,中心原子再提供2个电子,旁边两原子各提供一个电子构成一个特殊的共价键——三个原子均等地享有这四个电子,这种特殊的共价键的类型是________键(填σ或π),在高中化学中有一种常见分子的结合方式与O3相同,它是________(填分子式).
(4)③和⑨两元素比较,非金属性较弱的是________(填名称),可以验证你的结论的是下列中的________(填序号).
A、气态氢化物的挥发性和稳定性
B、单质分子中的键能
C、两元素的电负性
D、含氧酸的酸性
E、氢化物中X-H键的键长(X代表③和⑨两元素)
F、两单质在自然界的存在形式
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-物质的量 题型:022
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
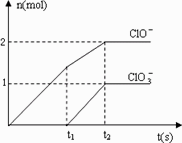
(1)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为:________.
(2)该石灰乳中含有Ca(OH)2的物质的量是________mol.
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同.
若在原石灰乳中通入氯气的速度加快,则反应后![]() ________2(填“>”、“<”或“=”);若
________2(填“>”、“<”或“=”);若![]() ,则n(C1-)=________mol(用含a的代数式来表示).
,则n(C1-)=________mol(用含a的代数式来表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com