
科目: 来源:江西省南昌市2008-2009学年高三调研测试卷化学试题 题型:022
V、U、W、S、X、Y、Z七种原子序数依次递增的短周期元素,已知
①V与U、W、S均能形成10电子和18电子的两种共价化合物A1、A2;B1、B2;C1、C2.其中A1、B1、C1为10e-微粒,A2、B2、C2为18e-微粒.
②S能与X形成两种离子化合物D1,D2,且晶体中阳离子与阴离子个数比均为2 J.
③S与Y的阴离子带有相同的电荷数.
④Z一离子最外层电子数等于次外层电子数.
回答下列问题:
(1)写出A1的空间构型:___________;
C2的电子式:____________________;
(2)制取Z单质的工业名称叫________工业;化工原理(用离子方程式表示):______________;
(3)V、w、S、Y四种元素组成原子个数比Nv∶NW∶NS∶NU=8∶2∶4∶1,的化合物分子式为____________;水溶液呈________性(填“酸性”、“中性”或“碱性”);原因(用离子方程式表_______________;
(4)B2可作为“绿色”火箭推进剂,已知16 g液态B2与液态C2反应,当生成两种气态物质时放出321.1 kJ热量,写出该反应的热化学方程式:_________.
查看答案和解析>>
科目: 来源:江苏省金陵中学河西分校2009届高三化学月考试卷人教版 人教版 题型:022
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0.
CH3OH(g) ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母)
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是__________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:

(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率________.
结论二:CO2含量对反应的影响为__________________
查看答案和解析>>
科目: 来源:江苏省金陵中学河西分校2009届高三化学月考试卷人教版 人教版 题型:022
化合物A是石油化工的一种重要原料,用A和水煤气为原料经图所示途径合成化合物D(分子式为C3H6O3).

请回答下列问题:
(1)写出下列物质的结构简式:A________;B________;C________;D________.
(2)指出反应②的反应类型:________.反应④的目的是________
(3)写出反应③的化学方程式:________.
(4)化合物![]() 是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物.
是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物.![]() 在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4).请分别写出
在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4).请分别写出![]() 生成E和F的化学方程式:
生成E和F的化学方程式:
![]() →E:____________.
→E:____________.
![]() →F:____________.
→F:____________.
查看答案和解析>>
科目: 来源:江苏省金陵中学河西分校2009届高三化学月考试卷人教版 人教版 题型:022
硅——无机非金属材料的主角.未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是化合物G.
(1)化合物G的相对分子质量为140,G为两种元素组成的化合物,其中硅元素的质量分数为60%,另一种元素为空气中含量最高的元素Y.
①化合物G的化学式为________,
②G可以由四氯化硅与NH3在反应而生成,同时产生HCl气体.写出反应方程式________
(2)粉末状G在高温下可与水发生反应,写出其反应方程式________;
(3)水泥是重要的无机非金属材料之一,普通水泥在固化过程中自由水分子减少并形成碱性溶液.根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是________
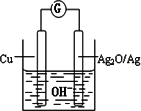
A.工业上以黏土、石灰石和石英为主要原料来制造普通水泥
B.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
C.测量原理示意图中,电流方向从Cu→Ag2O
D.电池工作时,OH-向正极移动
(4)已知粗硅提纯,总反应式可用表示为:
SiCl4(g)+2H2(g) Si(s)+4HCl(g),ΔH=+236 kJ·mol-1下表是部分化学键的键能数据:
则上表中x=________.
查看答案和解析>>
科目: 来源:江苏省金陵中学河西分校2009届高三化学月考试卷人教版 人教版 题型:022
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程图.
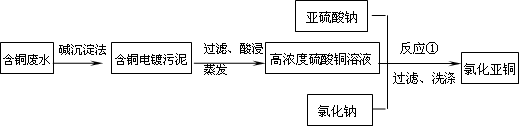
请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式:________.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是________.
(3)下图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在时,CuCl产率能达到94%.随后随温度升高CuCl产率会下降,其原因是________.

(4)若要提高CuCl的产率你认为还可采取的措施有________.
查看答案和解析>>
科目: 来源:江苏省金陵中学河西分校2009届高三化学月考试卷人教版 人教版 题型:022
已知B、D、E、F、G是氧化物,F、K是氢化物;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去).

请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1∶1∶1∶14.A强热分解的化学反应方程式________.
(2)写出反应②在工业生产上的一种用途:__________.
(3)反应③的离子方程式为________;
反应④的化学方程式为__________.
(4)常以C或H制成容器盛装和运输I的浓溶液,其原理是________.
查看答案和解析>>
科目: 来源:湖南师大附中2009届高三第五次月考化学试题 湘教版 湘教版 题型:022
下图中每一方框中的字母代表一种反应物或生成物,已知A、B、C、D均为单质,且D是淡黄色固体.产物J是含A元素的白色胶状沉淀,I为NaCl溶液.试填写下列空白:

(1)L的化学式为________,形成的晶体类型为________;
(2)实验室配制E的溶液时,应将固体E溶于________;
(3)E+F+L反应的离子方程式为___________.
查看答案和解析>>
科目: 来源:湖南师大附中2009届高三第五次月考化学试题 湘教版 湘教版 题型:022
据报道,我国拥有完全自主产权的氢氧燃料电池已在奥运会期间为运动员提供服务.燃料电池作为一种新型能源,由于其电极材料丰富,电解质多种多样(可以是固态、液态、气态等),将渗透到我们生活的各个领域.
(1)碱性燃料电池是采用30%~50%KOH溶液作电解质溶液,以H2为燃料在一定条件下使其发生反应,则该电池的正极电极反应式为________.工作一段时间后,电解液中溶液的pH将________(填“增大”、“减小”或“不变”)
(2)已知燃烧1 g氢气生成液态水放出热量143 kJ,某燃料电池以H2作燃料,写出该反应的热化学方程式__________________,氢氧燃料电池用于航天飞船,通过电极反应产生的水经冷凝后可供航天员饮用,当得到1.8 L饮用水时,电池内转移电子的物质的量约为________
A.1.8 mol
B.3.6 mol
C.100 mol
D.200 mol
查看答案和解析>>
科目: 来源:湖南省雅礼中学2009届高三第四次月考化学试题 题型:022
反应aA(g)+bB(g)![]() cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b.则
cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b.则
(1)平衡时A与B的转化率之比是________.
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b)________(c+d)(填“>”“=”“<”或“没关系”).
(3)设定a=2,b=1,c=3,d=2,在甲、乙、丙、丁4个相同的容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0.则在相同温度下达到平衡时,A的转化率最大的容器是________,B的转化率由大到小的顺序是________(填容器序号).
查看答案和解析>>
科目: 来源:湖南省雅礼中学2009届高三第四次月考化学试题 题型:022
在T℃时,水的离子积为KW=10-12,在此温度下,将pH=a的盐酸溶液Va L与pH=b的Ba(OH)2溶液Vb L混合:
(1)由数据可以判断T________25(填“大于”、“小于”、“等于”);理由是:________.
(2)若所得混合液为中性,且a+b=10,则Va∶Vb为___________;
(3)若所得混合液的pH=10,且a=2,b=12则Va∶Vb为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com