
科目: 来源:天津市汉沽一中2009届高三第四次月考化学试题 地区通用 题型:022
糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.
(1)血糖是指血液中的葡萄糖(C6H12O6).下列说法正确的是________(错选倒扣分)
A.葡萄糖属于碳水化合物,分子可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖也高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)木糖醇[CH2OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后不会升高血糖.请预测木糖醇的一种化学性质(写反应方程式):________
(3)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物A.A的实验结果如下:
Ⅰ、通过样品的质谱测得A的相对分子质量为60
Ⅱ、核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:乙醇(CH3CH2OH)有三种氢原子(图1).经测定,有机物A的核磁共振氢谱示意图如图2
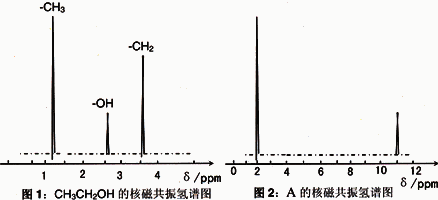
Ⅲ、将A溶于水,滴入石器试液,发现溶液变红.
试推导写出A的结构简式为________.
(4)糖尿病人宜多吃蔬菜和豆类食品.蔬菜中富含纤维素,豆类食品中富含蛋白质.下列说法错误的是:________(填序号,错选倒扣分)
A.蛋白质都属于天然有机高分子化合物,蛋白质都不溶于水
B.用灼烧闻气味的方法可以区别合成纤维和羊毛
C.人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D.紫外线、医用酒精能杀菌消毒,是因为使细菌的蛋白质变性
E.用天然彩棉制成贴身衣物可减少染料对人体的副作用
(5)香蕉属于高糖水果,糖尿病人不宜食用.乙烯是香蕉的催熟剂,可使澳的四氯化碳溶液褪色,试写出该反应的化学方程式:________
查看答案和解析>>
科目: 来源:天津市汉沽一中2009届高三第四次月考化学试题 地区通用 题型:022
水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)![]() CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.

(2)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0 mol炭和1.0 mol水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍.平衡时水蒸气的转化率为________;向该容器中补充a mol炭,水蒸气的转化率将________(填“增大”、“减小”、“不变”),再补充a mol水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为________.
(3)己知:C(s)+![]() O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
CO(g)+![]() O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
那么,将2.4 g炭完全转化为水煤气,然后再燃烧,整个过程ΔH=________kJ·mo1-1
查看答案和解析>>
科目: 来源:天津市汉沽一中2009届高三第四次月考化学试题 地区通用 题型:022
铅土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料.提取氧化铝的工艺流程如下:
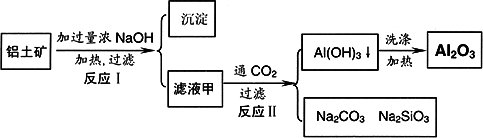
(1)滤液甲的主要成分是______________
(2)写出反应Ⅱ的离子方程式:________
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是________(填字母序号)
a.AlO2―或Al(OH)4-
b.OH―
c.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失.写出阴极的电极反应方程式________,沉淀消失的原因可用离子方程式表示为:________
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解.请画出生成沉淀的物质的量与加入盐酸体积的关系图.

查看答案和解析>>
科目: 来源:四川省洪雅中学高三2009年二月份月考理综试题化学部分 题型:022
物质间的转化关系如下图所示:
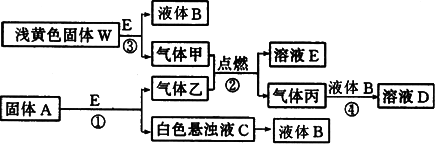
(1)写出反应③的离子方程式________,生成标准状况下5.6 L气体甲,则转移电子的物质的量为________mol.
(2)固体A是一种重要的工业原料.1 mol气体乙完全燃烧时生成l mol E和2 mol丙.则乙的电子式为________,其分子空间构型是________.
(3)C溶液中的溶质和丙以物质的量之比1∶2反应时.该反应的离子方程式为________.
若甲和乙恰好完全反应.则A与W的物质的量之比为________.
(4)将1 mol气体丙通入含1.5 mol B的溶液中恰好完全反应得溶液D,则D溶液中各离子浓度由大到小的顺序是________.
查看答案和解析>>
科目: 来源:四川省洪雅中学高三2009年二月份月考理综试题化学部分 题型:022
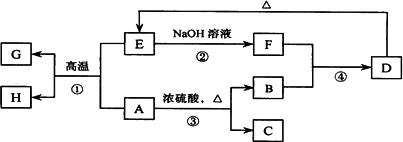
已知A、B、C、D、E、F、G、H可以发生如下图所示的转化,反应中部分生成物已略去.其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物.
请填空:
(1)H的名称是____________.
(2)E的两种用途是________、________.
(3)反应③的化学方程式是____________.
(4)反应④的离子方程式是____________.
查看答案和解析>>
科目: 来源:四川省洪雅中学高三2009年二月份月考理综试题化学部分 题型:022
元素X、Y、Z、W均为短周期元素,且原子序数依次增大.已知Y原子最外层电子数占核外电子总数的3/4,W-、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素.据此回答下列问题:
(1)W在元素周期表中的位置:________,工业上生产W单质的离子方程式为:________.
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1.若A能抑制水的电离,而B能促进水的电离,则A、B的化学式________、________.
(3)C是由上述四种元素中的两种组成的一种含有非极性键的离子化合物,则C的电子式为________.1 g X的气态单质与W的气态单质反应生成气态XW时放出92.3 kJ热量,该反应的热化学方程式为________.
(4)用B在碱性条件下可以处理含CN-的工业废水,请将下列6种微粒:CN-、CO![]() 、N2、OH-、B中阴离子、W的阴离子,分别填入下面对应的横线上,组成一个配平的离子方程式:
、N2、OH-、B中阴离子、W的阴离子,分别填入下面对应的横线上,组成一个配平的离子方程式:
________+________+________![]() ________+________+________+________
________+________+________+________![]()
查看答案和解析>>
科目: 来源:山东省临沂高新区实验中学2008-2009学年高三12月月考化学试题 人教版 人教版 题型:022
合成氨工业对化学工业和国防工业具有重要意义.
(1)常温下氨气极易溶于水,其水溶液可以导电.
①用方程式表示氨气溶于水的过程中存在的可逆过程__________________
②氨水中水电离出的c(OH-)________10-7 mol/L(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到依次为________.
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B.A为铵盐,B在标准状况下为气态.在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol A.
①写出氨气和氟气反应的化学方程式________;
②在标准状况下,每生成1 mol B,转移电子的物质的量为________mol.
(3)Ⅰ在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
达到平衡时,体积为反应前的三分之二.求:
①达到平衡时,N2的转化率为________.
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.试比较反应放出的能量:①________②(填“>”、“<”或“=”)
Ⅱ若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡.
③试比较平衡时NH3的浓度:Ⅰ________Ⅱ(填“>”、“<”或“=”).
查看答案和解析>>
科目: 来源:山东省临沂高新区实验中学2008-2009学年高三12月月考化学试题 人教版 人教版 题型:022
短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素.A、B、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子灵敏之和与D的最外层电子数相等.
请回答下列问题:
(1)D的最高价氧化物对应水化物名称为________.
(2)C2B2的电子式为________,其中含有的化学键类型为________.
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应离子方程式为________________.
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为________,若反应后溶液的体积为200 mL,测得pH为13,则阳极得到的气体质量为________,外电路中通过的物质的量为________
(5)实验室欲检验CD溶液中所含的D-,操作方法和现象为________
查看答案和解析>>
科目: 来源:江西省南昌市2008-2009学年高三调研测试卷化学试题 题型:022
在一体积可变的密闭容器中,充人0.1 mol NO气体,活塞处于B处,当A赴缓缓通人CO2气体使其与乙处物质D发生反应,产生气体进人甲中.活塞从B处逐渐移到C处.体积达到最小值,此时甲处气体体积为原来的![]() .据此回答下列问题:
.据此回答下列问题:

(1)写出甲处发生反直的化学方程式:___________
(2)试解释活塞从B处移到C处达到最小值的理由___________
(3)到达c处后,若继续通CO2,出现的现象是___________
若要甲中气体体积不变,则乙处物质D的质量最少应为___________
查看答案和解析>>
科目: 来源:江西省南昌市2008-2009学年高三调研测试卷化学试题 题型:022
A→J均由短周期元素组成,E、F、H为单质(其中有一种为金属),其余为化合物.且E+H→B,常温下B为液体;它们之问具有下图所示的相互转化关系:
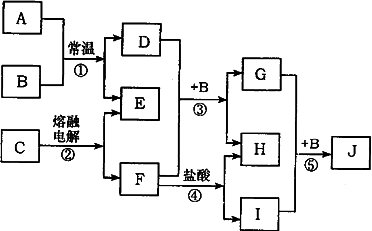
(1)D中含有的化学键:________
(2)写出下列反应的离子方程式
③_______________
⑤_______________
(3)E、F和海水可制戚新型“海洋电池”.可作为航标灯电源.该电池的电极材科为_________其正极的电扳反应式为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com