
科目: 来源:2009年高考化学(上海卷) 题型:022
尼龙-
66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出两条合成路线).
完成下列填空:
(1)写出反应类型:反应②________反应③________
(2)写出化合物D的结构简式:________
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:_______________
(4)写出反应①的化学方程式:________
(5)下列化合物中能与E发生化学反应的是________.
a.NaOH
b.Na2CO3
c.NaCl
d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):
_____________
查看答案和解析>>
科目: 来源:2009年高考化学(江苏卷) 题型:022
生物质能是一种洁净、可再生能源.生物质气
(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.(1)上述反应的催化化剂含有Cu、Zn、Al等元素.写出其态Zn原子的核外电子排布式________.
(2)根据等电子原理,写出CO分子的结构式________.
(3)甲醇催化氧化可得到甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀.
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子中碳原子轨首的杂化类型为________.
②甲醛分子的空间构型是________;1 mol甲醛分子中a键的数目为________.
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为________.
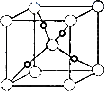
查看答案和解析>>
科目: 来源:2009年高考化学(江苏卷) 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2009年高考化学(江苏卷) 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2009年高考化学(江苏卷) 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2009年高考化学(海南卷) 题型:022
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化
(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸.请回答下列问题:(1)氨催化氧化的化学方程式为________:
(2)原料气中空气必须过量,其主要原因是________;
(3)将铂铑合金做成薄丝网的主要原因是________;
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为________,为了提高水对二氧化氮的吸收率,可采取的措施为________(答2项)
查看答案和解析>>
科目: 来源:2009年高考化学(海南卷) 题型:022
已知
A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.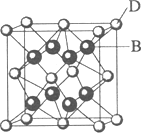
请回答:
(1)A元素的名称是________;
(2)B的元素符号是________,C的元素符号是________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是________
(3)E属元素周期表中第________周期,第________族的元素,其元素名称是________,它的+2价离子的电子排布式为________:
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是________(只要求列出算式).
查看答案和解析>>
科目: 来源:2009年高考化学(广东A卷) 题型:022
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(1)Cu位于元素周期表第IB族.Cu2+的核外电子排布式为________.
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________.
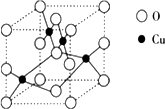
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)]SO4·H2O,其结构示意图如下:
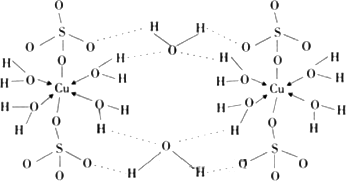
下列说法正确的是
________(填字母).A.在上述结构示意图中,所有氧原子都采用SP3杂化SP3
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH2)2]2+配离子.已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是________.
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因________.
查看答案和解析>>
科目: 来源:2009年高考化学(广东A卷) 题型:022
叠氮化合物应用广泛,如
NaN3,可用于汽车安全气毂pHCH2N3r可用于合成化合物V(见下图,仅列出部分反应条件PH-代表苯基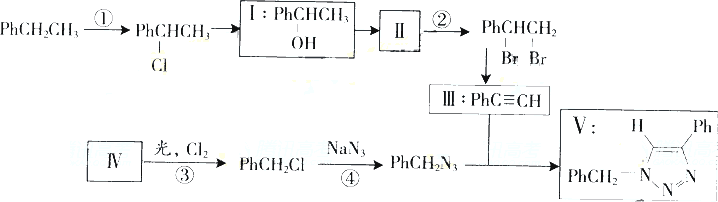
(1)下列说法不正确的是________(填字母)
A反应①④属于取代反应
B化合物Ⅰ可生成酯,但不能发生氧化反应
C一定条件下化合物Ⅱ能生成化合物Ⅰ
D一定条件下化合物Ⅱ能与氢气反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为________(不要求写出反应条件)
(3)反应③的化学方程式为________(要求写出反应条件)
(4)化合物Ⅲ与pHCH2N3发生环加成反应成化合物Ⅴ,不同条件下环加反应还可生成化合物Ⅴ的同分异构体.该同分异物的分子式为________结构式为________
(5)科学家曾预言可合成c(N3)4.其可分解成单质,用作炸药.有人通过NaN3与NC-CCl3.反应成功全成了该物质下列说法正确的是________(填字母)
A该合成反应可能是取代反应
Bc(N3)4与甲烷具有类似的空间结构
Cc(N3)4不可能与化合物Ⅲ发生环加反应
Dc(N3)4分解爆炸的化学反应方程式可能为c(N3)4→C+6N2↑
查看答案和解析>>
科目: 来源:2009年高考化学(广东A卷) 题型:022
磷单质及其化合物的、有广泛应用.
(1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来
________.②已知相同条件下:
4Ca3(PO4)2(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSio3(s)+SiF4(g) ΔH1
2Ca3s(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用Δ
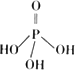
H1、ΔH2和ΔH3表示ΔH,ΔH=________(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见图)之间脱去两个分子产物,其结构式为________.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为________
(3)次磷酸钠(NaH2PO2)可用于化学镀镍.
①NaH2PO2中P元素的化合价为________.
②化学镀镍的溶液中含有和,在酸性等条件下发生下述反应:
(a)________N12++________H2PO2+________→________Ni+________H2PO3+________
(b)6H2PO2+2H+=2P+4H2PO3+3H2↑
请写出并配平反应式(a).
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:________;原理上的不同点:________;化学镀的优点:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com