
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
已知A、B、C、D、E为周期表里1~20号元素中的五种.又知:
①A与D同族,B与E同族,B与C同周期;
②E的原子序数为奇数,A与E的原子序数之和为28;
③0.1 mol C单质与足量的E的最高价氧化物对应水化物的溶液反应生成3.36 L(标准状况)的氢气.
请回答下列问题:
(1)写出A和C的元素符号:A________、C________.
(2)写出B元素的单质在空气中燃烧后产物的电子式________.
(3)C的单质与足量的E的最高价氧化物对应的水化物的溶液反应的离子方程式为:
_________________________________
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
苹果酸是一种常见的有机酸,其结构简式为![]() .
.
(1)苹果酸分子中所含的官能团名称是________.
(2)苹果酸可以发生的化学反应有________(填序号).
①水解反应 ②取代反应 ③氧化反应 ④消去反应 ⑤加聚反应
(3)苹果酸与乙酸发生酯化反应的化学方程式为(请注明反应条件)________.
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
将4 mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0,在相同温度下,使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2 mol;乙容器经50 s达到平衡状态.请回答:
2SO3(g);ΔH<0,在相同温度下,使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2 mol;乙容器经50 s达到平衡状态.请回答:

(1)甲容器达到平衡时SO2的转化率是________,其所需时间________50 s(填“大于”“小于”或“等于”).
(2)达到平衡状态后,要使甲、乙两容器中SO2物质的量相等,可采取的措施是________(填字母).
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
Ⅰ在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol.达到平衡时,体积为反应前的三分之二.求:
2NH3(g);ΔH=-92.4 kJ/mol.达到平衡时,体积为反应前的三分之二.求:
(1)达到平衡时,N2的转化率为________.
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.试比较反应放出的能量:(1)________(2)(填“>”“<”或“=”).
Ⅱ若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡.试比较平衡时NH3的浓度:Ⅰ________Ⅱ(填“>”“<”或“=”).
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
目前世界上比较先进的电解制碱技术是离子交换膜法.
(1)电解法制烧碱的主要原料是饱和食盐水.由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、![]() 等杂质,因此必须经过精制才能进行电解.除去这些杂质时,不应选用的试剂是________(填序号).
等杂质,因此必须经过精制才能进行电解.除去这些杂质时,不应选用的试剂是________(填序号).
a.BaCl2 b.Na2CO3 c.NaOH d.盐酸 e.KOH
(2)现有200 mL食盐水,用石墨电极电解.当阴极产生气体的体积为0.224 L(标准状况)时停止电解,阳极的电极反应式为________,电解后,溶液在常温下的pH约为________(忽略体积变化).
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
铁酸钠(化学式为Na2FeO4)是一种新型净水剂,工业上常通过如下化学反应制取:
Fe2O3+3NaNO3+4NaOH![]() 2Na2FeO4+3NaNO2+2H2O.
2Na2FeO4+3NaNO2+2H2O.
(1)反应中,氧化剂为________.
(2)当生成4mol Na2FeO4时,电子转移总数为________mol.
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
几种短周期元素的原子半径及其某些化合价见下表:

分析上表中有关数据,并结合已学过的知识,回答以下问题.涉及上述元素的答案,请用元素符号表示.
(1)E元素在周期表中位于________周期,________族;
(2)A、H、J对应离子的半径由大到小的顺序是(填离子符号)________;
(3)A与J所形成化合物的晶体类型是________,用电子式表示其形成过程________;
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为________;D与B形成的某种化合物Y不仅能与X反应,还能与I的单质反应.则Y与I的单质反应的化学方程式为________.
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:022
砷酸铅可用作杀虫剂.已知①在砷酸铅中,砷处于最高价态,铅处于稳定价态;②砷酸铅是正砷酸对应的盐,1 mol正砷酸分子中含有8 mol原子.请回答以下问题:
(1)砷的元素符号是________;
(2)砷的最高价氧化物的化学式为________;铅的最高价氧化物的化学式为________;
(3)砷酸铅的化学式为________.
查看答案和解析>>
科目: 来源:北京市海淀区2009年高三化学查漏补缺题 题型:022
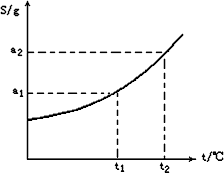
某物质的摩尔质量为M g/mol,其溶解度曲线如图所示,现有t2℃ 300 g该物质的溶液,在温度不变时蒸发掉50 g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ g/mL,则饱和溶液的物质的量浓度为________,若将此饱和溶液降温至t1℃时,则析出晶体(不含结晶水)的质量为________.
查看答案和解析>>
科目: 来源:2009年高考化学(上海卷) 题型:022
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:![]()
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为________g/mol(保留一位小数).
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L.
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g.则原混合气中臭氧的体积分数为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com