
科目: 来源:江西省莲塘一中2010届高三上学期第一次月考化学试题 题型:022
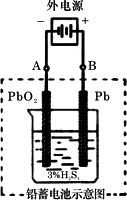
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO2-4![]() 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g.
(2)在完全放电耗尽PbO2和Pb时,若按题下图连接,电解一段时间后,则在A电极上生成________、B电极上生成________,此时铅蓄电池的正负极的极性将________.
查看答案和解析>>
科目: 来源:江西省莲塘一中2010届高三上学期第一次月考化学试题 题型:022
已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:
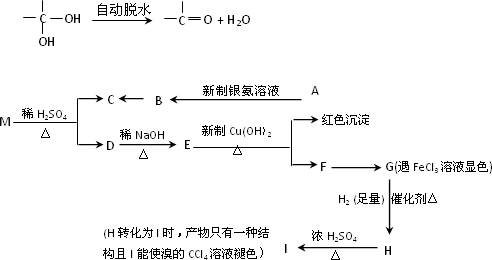
现有分子式为C9H8O2Br2的物质M,有机物C的相对分子质量为60,在一定条件下可发生下述一系列反应:
请回答下列问题:
(1)G→H的反应类型是________.
(2)C的结构简式为________;M的结构简式为________.
(3)写出下列反应的化学方程式:
①A→B的化学方程式:________;
②H→I的化学方程式:________.
查看答案和解析>>
科目: 来源:江西省莲塘一中2010届高三上学期第一次月考化学试题 题型:022
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
(1)原溶液中肯定存在的离子是________,肯定不存在的离子是________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?________.
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①________
②________
③________
④________
⑤________
查看答案和解析>>
科目: 来源:江西省莲塘一中2010届高三上学期第一次月考化学试题 题型:022
A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:
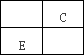
请回答:
(1)D、E组成的常见的化合物,其水溶液呈碱性,原因是________(用离子方程式表示).
(2)E的单质能跟D的最高价氧化物对应水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式________.
(3)C、F所形成的化合物为离子化合物,其晶体结构模型如下:
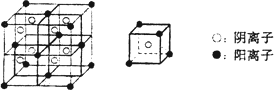
该离子化合物的化学式为________.
(4)4.0 g E的单质在足量的B的单质中完全燃烧,放出37.0 kJ热量,写出其热化学方程式:____________________.
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH浓溶液,两极均有特制的防止气体透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的________极;B极的电极反应式是________.
查看答案和解析>>
科目: 来源:广东英德中学2010届第一次月考理科综合化学试题 题型:022
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3
2O3
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为________g/mol(保留一位小数).
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L.
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g.则原混合气中臭氧的体积分数为________.
查看答案和解析>>
科目: 来源:湖南株洲市四中2010届高三第一次月考化学试卷 题型:022
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
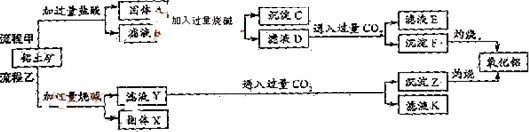
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为________.
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________.
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称).
(4)滤液E、K中溶质的主要成份是________(填化学式).
(5)已知298 K时,Mg(OH)2的容度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=________.
查看答案和解析>>
科目: 来源:湖南株洲市四中2010届高三第一次月考化学试卷 题型:022
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
(1)滴定
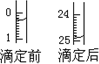
①用酸式滴定管盛装c mol/L盐酸标准液.下图表示某次滴定时50 mL滴定管中滴定前后液面的位置.用去的标准盐酸的体积为________mL.
②下表是4种常见指示剂的变色范围:
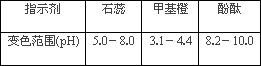
该实验应选用________作指示剂;
③有关数据记录如下:
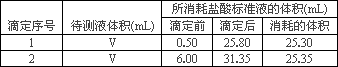
(2)根据1、2所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
c=________.
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果________;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果________;
c.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果________.
查看答案和解析>>
科目: 来源:湖南株洲市四中2010届高三第一次月考化学试卷 题型:022
已知某溶液中只有Na+、CH3COO-、H+、OH-四种离子.某同学推测该溶液中个离子浓度可能有如下四种关系:
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
①若溶液中只溶解了一种溶质,该溶质的名称是________,上述离子浓度大小关系中正确的是(填序号)________;
②若上述关系中D是正确的,则溶液中溶质的化学式是________;
③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,则混合前c(CH3COOH)(填“>”“<”“=”,下同)________c(NaOH),混合后c(CH3COO-)与c(Na+)的关系是c(CH3COO-)________c(Na+).
查看答案和解析>>
科目: 来源:湖南株洲市四中2010届高三第一次月考化学试卷 题型:022
Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
请回答下列问题:
(1)电池的负极发生的电极反应为________;
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,实验现象是________,反应的化学方程式为________;
(3)组装该电池必须在无水、无氧的条件下进行,原因是________.
查看答案和解析>>
科目: 来源:河北省正定中学2010届高三上学期第一次月考化学 题型:022
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:![]() +5Cu2S+44H+
+5Cu2S+44H+![]() 10Cu2++5SO2+8Mn2++22H2O
10Cu2++5SO2+8Mn2++22H2O
![]() +5CuS+28H+
+5CuS+28H+![]() 5Cu2++5SO2+6Mn2++14H2O反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应.
5Cu2++5SO2+6Mn2++14H2O反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应.
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
![]()
![]() +
+![]() Fe2++
Fe2++![]() H+
H+![]()
![]() Mn2++
Mn2++![]() Fe3++
Fe3++![]() H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol.
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g.
(4)混合物中Cu2S的质量分数为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com