
科目: 来源:甘肃省兰州五十五中2009-2010学年度第一学期期末试卷高三化学 题型:022
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、![]() ,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示:根据题意同答下列问题:
,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示:根据题意同答下列问题:
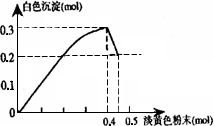
(1)淡黄色粉末为________(填名称)
(2)溶液中肯定有________离子,肯定没有________.
(3)溶液中离子的物质的量之比为________
(4)写出下列方程式:
①淡黄色粉末与水反应的化学方程式:________________________
②产生刺激性气味气体的离子方程式:________________________
③沉淀部分减少时的离子方程式:____________________________
查看答案和解析>>
科目: 来源:甘肃省兰州五十五中2009-2010学年度第一学期期末试卷高三化学 题型:022
在一定条件下,![]() 和I-可以发生反应,离子方程式为:
和I-可以发生反应,离子方程式为:![]() +6I-+6H+=R-+3I2+3H2O
+6I-+6H+=R-+3I2+3H2O
(1)![]() 中n的值为________;反应中电子转移的数目为________.
中n的值为________;反应中电子转移的数目为________.
(2)![]() 中R元素的化合价为________.
中R元素的化合价为________.
(3)R元素最外层的电子数是________.
查看答案和解析>>
科目: 来源:福建省泉州市德化县2010届高三上学期期末考试化学试卷 题型:022
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极.
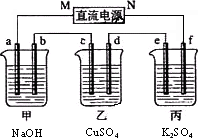
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电极b上发生的电极反应为________;
②电解后各溶液的pH(填“增大”、“减小”或“不变”):
甲溶液________;丙溶液________.
③计算电极b上生成的气体在标准状态下的体积为________;
(2)如果电解过程中铜全部析出,此时________(填“能”或“否”)继续电解,若能,写出继续电解的总反应方程式:________________
.查看答案和解析>>
科目: 来源:福建省泉州市德化县2010届高三上学期期末考试化学试卷 题型:022
设水的电离平衡曲线如图所示.
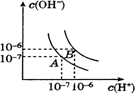
(1)若以A点表示水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态变化到B点,则此时水的离子积从________增加到________.
(2)将pH=8的NaOH溶液与pH=5的稀硫酸相混合,并保持100℃的恒温,欲使混合液的pH=7,则NaOH与稀硫酸体积比为________.(假设溶液体积可加和)
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试、化学(天津卷) 题型:022
黄铁矿主要成分是FeS2.某硫酸厂在进行黄铁矿成分测定时,取0.100 0 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020 00 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL.
已知:SO2+2Fe3++2H2O==SO2-+2Fe2++4H+
![]() +6Fe2++14H+==2Cr3++6Fe3++7H2O
+6Fe2++14H+==2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________.
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:________________________________.
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为________L,制得98%的硫酸质量为________t,SO2全部转化为H2SO4时放出的热量是________kJ.
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试、化学(天津卷) 题型:022
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素.Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体.X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体.
请回答下列问题:
(1)V的单质分子的结构式为________;XW的电子式为________;
Z元素在周期表中的位置是________________.
(2)U元素形成的同素异形体的晶体类型可能是(填序号)________.
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)________;V、W的氢化物分子结合H+能力较强的是(写化学式)________,用一个离子方程式加以证明________________________.
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为________________________________,由此可知VW和YW2还原性较强的是(写化学式)________.
查看答案和解析>>
科目: 来源:祁东县鼎兴补习学校2010届高三化学第一次月考化学试题卷 题型:022
2008年5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等.
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式:________.
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是________.
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平).当1 mol HClO2发生分解反应时,转移的电子个数是________.
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中还原剂与氧化剂的物质的量之比为________.
查看答案和解析>>
科目: 来源:祁东县鼎兴补习学校2010届高三化学第一次月考化学试题卷 题型:022
设计出燃料电池使汽油氧化直接产生电流是对21世纪最富有挑战性的课题之一.最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.回答如下问题:
(1)以庚烷(C7H16)代表汽油,这个电池放电时发生的化学反应的化学方程式是:________
(2)这个电池的负极发生的反应是:________;正极发生的反应是:________;固体电解质里的O2-向________(填“正”或“负”)极移动
查看答案和解析>>
科目: 来源:祁东县鼎兴补习学校2010届高三化学第一次月考化学试题卷 题型:022
现有几种离子
A、B、C、D、E是由它们组成的五种可溶于水的固体(每种离子只能用一次),分别取它们进行实验,结果如下:
①将D与E的溶液混合加热,产生刺激性气味的气体;
②将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解;
③向一定量的E溶液中逐滴加入C溶液,先无明显现象,后来产生白色沉淀,且该沉淀可溶于A溶液;且A溶液的焰色反应火焰为黄色.
④D固体在一定温度下可以分解为水和另外两种均为空气主要成分的气体单质.
根据上述信息回答下列问题:
(1)根据以上条件推断并写出下列物质的化学式:
A________;B________;C________;D________;E________;
(2)写出A溶液与E溶液恰好完全反应至溶液呈中性的离子方程式:________.
(3)写出D固体分解的化学方程式________.
查看答案和解析>>
科目: 来源:祁东县鼎兴补习学校2010届高三化学第一次月考化学试题卷 题型:022
(1)0.25 mol某固体A的质量是15 g,A的相对分子质量为________.
(2)在25℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________.
(3)两个同容积的密封容器A、B,在25℃下,A中充入a g A气体,B中充入a g CH4气体,A与B内的压强之比是4∶11,则A的摩尔质量为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com