
科目: 来源:上海市徐汇区2010届高三第二次模拟考试化学试题 题型:022
某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究.
(1)制备硫酸亚铁溶液,最合适的试剂组为________(填编号);
a
.过量铁屑和稀硫酸b
.过量稀硫酸和铁屑c
.过量硫酸铁溶液和铁屑(2)实验室保存硫酸亚铁溶液的一般方法是________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3滴KSCN试剂,然后进行如下实验:

(3)在烧杯②中加入2种试剂后,即可观察到的现象为________;
(4)通过比较上述3组实验,可以得出的结论为________;
(5)硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大.
①试用一个离子方程式表示上述反应过程中的变化________;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因________.
查看答案和解析>>
科目: 来源:上海市徐汇区2010届高三第二次模拟考试化学试题 题型:022
SO2与O2在催化剂作用下合成SO3的反应为:2SO2(g)+O2(g)2SO3(g).在容积均为1L的a、b、c、d、e五个密闭容器中均充入1 mol O2和2 mol SO2混合气体,控温.反应进行5 min时,测得相关数据如下表:
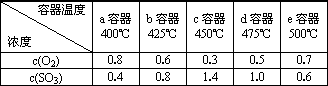
(1)反应进行5 min内,五个容器中平均反应速率最大的是________(填容器编号);
(2)计算a容器中O2的反应速率________;
(3)写出该反应的平衡常数表达式K=________,比较上表中数据,推测可能达到平衡的容器是________(填容器编号);
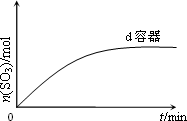
(4)该反应是________(填“放热”、“吸热”)反应,在下图坐标中画出e容器中SO3的物质的量随时间的变化曲线.
查看答案和解析>>
科目: 来源:上海市徐汇区2010届高三第二次模拟考试化学试题 题型:022
H2O2是在医疗、化工方面应用广泛的化学试剂.
(1)Na2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是________;
(2)实验室可用H2O2与次氯酸钠反应制氧气,其中还原剂是________,写出反应的化学方程式________,生成0.5mol氧气,转移电子________mol;
(3)用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,有两位同学分别用以下化学方程式表示其中的反应原理:
①5H2O2+2KMnO4+3H2SO4
→2MnSO4+K2SO4+5O2↑+8H2O②3H2O2+2KMnO4+3H2SO4
→2MnSO4+K2SO4+4O2↑+6H2O你认为其中错误的是________(认为没有可以不填),简述理由________.
查看答案和解析>>
科目: 来源:上海市徐汇区2010届高三第二次模拟考试化学试题 题型:022
下表为元素周期表的短周期部分.请填空.
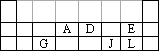
(1)
写出A原子的最外层电子的轨道表示式________,G、J、L三种元素形成的简单离子中,离子半径最小的是________;(2)A元素可形成化合物
Fe(AO)5,该物质常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(AO)5晶体属于________(填晶体类型);(3)将D元素的气态氢化物通入稀硫酸中,写出反应的离子方程式________;
(4)M与E同主族且核外电子比E多三个电子层,M位于元素周期表________周期________族,
有研究显示HMO具有两性,则HMO与盐酸反应化学方程式为________.查看答案和解析>>
科目: 来源:上海市虹口区2010届高三第二次模拟考试化学试题 题型:022
苯佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯.用芳香烃A为原料合成苯佐卡因E的路线如下:
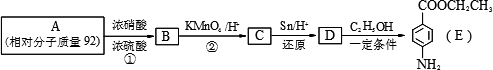
请回答:
(1)写出结构简式B________ C________.
(2)写出反应类型①________ ②________.
(3)化合物D经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.写出该聚合反应的化学方程式:________.
(4)下列化合物中能与E发生化学反应的是________.
a.HCl
b.NaCl
c.Na2CO3
d.NaOH
(5)
除ⅰ.为1,4-二取代苯,其中苯环上的一个取代基是氨基;
ⅱ.分子中含![]() 结构的基团
结构的基团
查看答案和解析>>
科目: 来源:上海市虹口区2010届高三第二次模拟考试化学试题 题型:022
作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处理领域有着广泛应用.与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
(1)反应时,ClO2生成ClO2-、Cl-的转化率与溶液的pH的关系如图所示.则pH=8时,ClO2被还原为________.
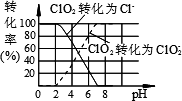
(2)亚氯酸根离子(ClO2-)对人体不利.欲在弱碱性条件下将水中的ClO2-转化为Cl-除去,若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2.写出、配平有关化学方程式,并标出电子转移的方向和数目:________.
(3)以下是ClO2的两种制备方法:
方法一
:2NaClO3+4HCl→2ClO2↑+Cl2↑+2NaCl+2H2O方法二
:2NaClO3+H2O2+H2SO4→2ClO2↑+O2↑+Na2SO4+2H2O①方法一,当有0.2mol电子发生转移时,参与反应的还原剂为
________mol.②方法二:该反应中H2O2
________(填序号).a.发生氧化反应
b.仅做氧化剂
c.既被氧化又被还原
d.既未被氧化也未被还原
③用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是________.
查看答案和解析>>
科目: 来源:上海市虹口区2010届高三第二次模拟考试化学试题 题型:022
组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有________(写元素符号),它的原子最外层共有________种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置________.
(2)糖类是人体获得能量的来源之一.已知
1 mol葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式________.(3)CO2是一种温室气体,它的电子式为________,将其转变其他化工原料,必须破坏的化学键属于________(填“极性”或“非极性”)键.
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是________(填序号).
a.离子半径:S2->Na+>O2->H+
b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3
d.还原性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:

根据表中数据,归纳共价键键能与键长的关系________.
查看答案和解析>>
科目: 来源:山东省莘县实验高中2010届高三上学期模拟考试化学试题 题型:022
标况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准碳酸钠溶液滴定这种盐酸时,碳酸钠溶液应装在________式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从________色变成________色.
(2)现配制三种浓度的标准碳酸钠溶液,你认为最合适的是下列第________种.
①2.500 mol/L
②0.25 mol/L
③0.025 mol/L
(3)若采用上述合适的标准碳酸钠溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
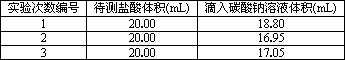
求这种待测稀盐酸的物质的量浓度(用题中所给数据列出计算式即可).
c(HCl)=________.
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度________,若滴定完毕后读数时俯视,则实验误差为________(以上两空填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目: 来源:河南省卢氏二高2010届高三上学期期末模拟高三化学试题 题型:022
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、MnO4-、Cl-、I-、NO3-、CO32-、S2-、SO42-、、SO32-、AlO2-中的几种.取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性,可排除________离子的存在.
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色,可排除________离子的存在.
(3)另取部分溶液,逐滴向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生.则又可排除________离子的存在.
(4)取部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明有________离子存在,又可排除________离子的存在.
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
根据上述五步实验事实确定:
①该溶液中肯定存在的离子是________;
②还不能确定是否存在的离子是________.
查看答案和解析>>
科目: 来源:河南省卢氏二高2010届高三上学期期末模拟高三化学试题 题型:022
有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断.
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C.
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体.
③F在常温下是气体,性质稳定,是除氢外最轻的气体.
④G是除氢外原子半径最小的元素(不考虑稀有气体).
(1)A的名称________;B位于周期表中第________周期,第________族;C的原子结构示意图是________.
(2)E的单质颜色是________.
(3)A元素与D元素形成的化合物的电子式是________.
(4)G的单质与水反应的化学方程式是________.
(5)F的元素符号是________.
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的物质的化学式是________;气态氢化物最稳定的物质的化学式是________.
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com