
科目: 来源:江苏省苏北四市2010届高三下学期第二次调研考试化学试题 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省苏北四市2010届高三下学期第二次调研考试化学试题 题型:022
聚-3-羟基丁酸酯(PHB)可用于制造可降解塑料等.PHB是由许多3-羟基丁酸分子聚合而成,合成聚-3-羟基丁酸酯的途径有很多,其中一种途径的副产品少、污染小、原子利用率高,其合成路线如下:
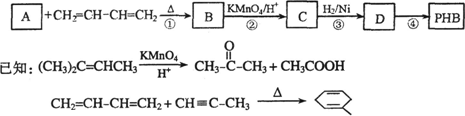
请回答下列问题:
(1)写出C中含有的官能团的名称:________.
(2)上述转化过程中属于加成反应的是________(填序号).
(3)反应②符合绿色化学思想(碳原子的有效利用率为100%),则A的结构简式为_______________.
(4)写出与C互为同分异构体,能发生银镜反应,且核磁共振氢谱有两个吸收峰的有机物的结构简式:_____________.
(5)反应④的化学方程式为______________.
(6)4-羟基丁酸钠(HOCH2CH2CH2COONa)是一种麻醉药.现以上述合成路线中的C物质为原料制取4-羟基丁酸钠,请写出其合成路线流程图(合成过程中无机试剂任选,并注明反应条件).
提示:由乙醇制取聚乙烯的合成路线流程图可表示为:
![]()
查看答案和解析>>
科目: 来源:江苏省苏北四市2010届高三下学期第二次调研考试化学试题 题型:022
随着工业的迅速发展,产生的废水对水体的污染也日趋严重.通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法.下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol·L-1时通常认为该离子沉淀完全).
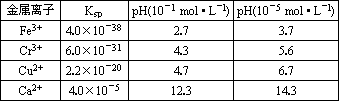
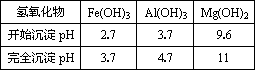
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol·L-l.为除去其中的Fe3+,回收铜,需控制的pH范围是________.
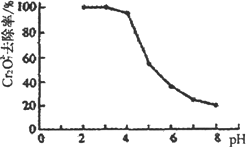
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准.
①Cr2O72-转变为Cr3+的离子方程式为_____________.
②pH对废水中Cr2O72-去除率的影响如图.你认为电解过程中溶液的pH取值在________范围内对降低废水中的铬含量最有利,请说明理由:______________.
[注:去除率(%)=[(c0-c)/co]×100%,式中:co-理前废水中Cr2O72-的浓度,c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用.例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=________(写数值).[已知Ksp(CaSO4)=9.1×10-6,Ksp(CaCO3)=2.8×10-9]
查看答案和解析>>
科目: 来源:江苏省苏北四市2010届高三下学期第二次调研考试化学试题 题型:022
近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ.则该反应的热化学方程式为_____________.
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理示意如图,其总反应式是:
H2+2NiOOH
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将________(填“增大”、“不变”或“减小”),该电极的电极反应式为___________.
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
CO(g)+1/2O2(g)![]() CO2(g).
CO2(g).
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请填写表中的空格.

②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5 mol·L-l和1.0×10-4 mol·L-l.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4 mol·L-1,则最终尾气中CO的浓度为________mol·L-1.
查看答案和解析>>
科目: 来源:江苏省苏北四市2010届高三下学期第二次调研考试化学试题 题型:022
锂被誉为“高能金属”.工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下:
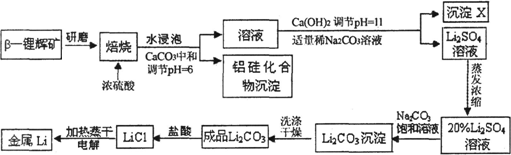
(1)用氧化物形式表示LiAlSi2O6的组成:________.
(2)沉淀X的主要成分是(写化学式)_____________.
(3)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因:_____________.
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体.试写出氢化锂遇水反应的化学方程式:_______________.
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂.电解时产生的氯气中会混有少量氧气,原因是_______________.
查看答案和解析>>
科目: 来源:江苏省南通市2010届高三第二次模拟考试化学试题 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省南通市2010届高三第二次模拟考试化学试题 题型:022
利用化学原理可以对工厂排放的废水进行有效检测与合理处理.
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为
________.(2)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)=
________mol/L.(已知Ksp[Ca3(PO4)2]=2×10-33)②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
_____________.与方法一相比,方法二的优点为_______________.(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
●CCl2=CHCl+Cl→CCl2CHCl2
●CCl2CHCl2+O2→OOCCl2CHCl2
●
OOCCl2CHCl2→OCCl2CHCl2+1/2O2●OCCl2CHCl2→CHCl2COCl+Cl
该反应的总化学反应为
_____________.查看答案和解析>>
科目: 来源:江苏省南京市2010届高三第二次模拟考试化学试题 题型:022
β-锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等.
以β-锂辉石为原料制备碳酸锂的一种流程如下:
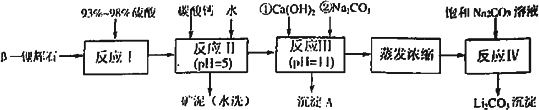
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
②Li2CO3在不同温度的溶解度如下表:
![]()
回答下列问题:
(1)反应Ⅱ中加碳酸钙的作用是________.
(2)写出反应Ⅲ中生成沉淀A的离子方程式________、________.
(3)写出反应Ⅳ的化学方程式________.洗涤所得Li2CO3沉淀要用热水而非冷水,原因是________.
查看答案和解析>>
科目: 来源:上海市徐汇区2010届高三第二次模拟考试化学试题 题型:022
烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化.异松油烯是应用广泛的工业原料,它与水反应(摩尔比1∶1)可得到γ-松油醇(结构见图).
(1)写出γ-松油醇的分子式________,该物质所属的物质类别为________(填编号);
a.烯烃
b.环烃
c.醇
(2)下列反应中,γ-松油醇不能发生是________(填编号);
a.与HCl发生取代反应
b.与HCl发生加成反应
c.在灼热铜丝催化下发生氧化反应
d.聚合反应
(3)已知异松油烯分子中有3个甲基,则其结构简式为________;
(4)异松油烯的同分异构体中,能与溴水发生1,4-加成的共有________种(仅考虑官能团位置异构),写出其中一种的结构简式________;
查看答案和解析>>
科目: 来源:上海市徐汇区2010届高三第二次模拟考试化学试题 题型:022
卤水中的主要成分为食盐(假设其所含杂质仅为NaBr),为了充分利用资源,有研究人员开发了以晒盐卤水和化肥碳酸氢铵为原料制取纯碱的工艺,其生产流程如下图.
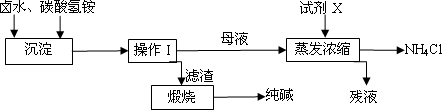
(1)写出卤水和碳酸氢铵反应的化学方程式________;
(2)操作I是________(填操作名称),试剂X为________,残液除NH4Cl外,还含有________;
(3)若滤渣中含有NH4Cl杂质,则可能导致纯碱中混有杂质,写出煅烧时产生杂质的副反应的化学方程式________;
(4)实验室检测滤渣中是否含有NH4Cl的操作是________;
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,如图是![]() (摩尔比)对NaHCO3产率的影响.实际生产中选择
(摩尔比)对NaHCO3产率的影响.实际生产中选择![]() =1.2.
=1.2.
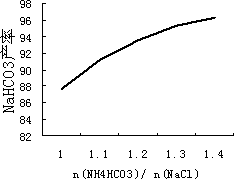
①下列相关说法正确的是________.
a.碳酸氢铵过量是为了充分利用卤水
b.碳酸氢铵过量是为了减少纯碱中的NaCl
c.碳酸氢铵过量太多将会导致生产成本过高
②不考虑生产过程中的损耗,生产1 mol纯碱,需消耗碳酸氢铵________mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com