
科目: 来源:上海市部分重点中学2010届高三第二次联考化学试题 题型:022
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体.为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(气体体积均折算到标准状况的体积):
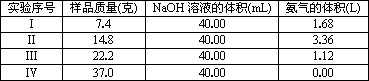
(1)实验过程中有关反应的离子方程式为:________;________.
(2)计算用1.85克样品进行同样实验时,生成氨气在标准状况的体积为________L
(3)计算确定该混合物中(NH4)2SO4和NH4HSO4的物质的量之比________.
(4)欲计算该NaOH溶液的物质的量浓度应选择第________组数据,由此求得NaOH溶液的物质的量浓度为________.
查看答案和解析>>
科目: 来源:上海市部分重点中学2010届高三第二次联考化学试题 题型:022
已知:IO3-+5I-+6H+→3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.
①NaIO3不足时:2NaIO3+6NaHSO3→2NaI+3Na2SO4+3H2SO4
②NaIO3足量时:4NaIO3+10NaHSO3→2I2+7Na2SO4+3H2SO4+2H2O
现模拟工业制取I2.在含31.2 g NaHSO3的溶液中逐滴加入2 mol/L NaIO3溶液v mL.
(1)当v=________mL时,再滴NaIO3就开始析出I2.
(2)当v为55 mL时,
生成的I2的质量为________g.查看答案和解析>>
科目: 来源:上海市部分重点中学2010届高三第二次联考化学试题 题型:022
工业制硝酸的主要反应是:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)+Q;Q=1025 kJ·mol-1
4NO(g)+6H2O(g)+Q;Q=1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________;升高温度K值________(填“增大”、“减小”或“不变”).
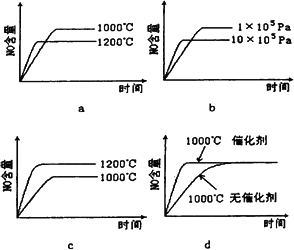
(2)若反应物起始的物质的量相同,下列关系图错误的是________(填序号).
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
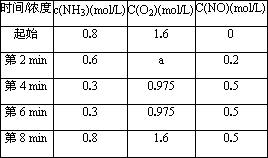
①起始时物料比c(O2):c(NH3)>1.25,其原因是________.
②反应在第2 min到第4 min时O2的平均反应速率为________mol/L
·min;③反应在第2 min改变了反应条件,改变的条件可能是________(填序号)
a.使用催化剂
b.升高温度
c.增大压强
d.增加O2的浓度
④反应在第8 min改变的反应条件可能是________.
查看答案和解析>>
科目: 来源:上海市部分重点中学2010届高三第二次联考化学试题 题型:022
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
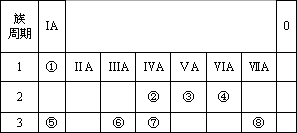
(1)④、⑤、⑥的原子半径由大到小的顺序为[填元素符号]________.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是[填化学式]________.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________.
(4)由②和④组成,且②和④的质量比为3∶8的化合物的结构式是________,其中含________键,(填“极性”或“非极性”下同)属于________分子该物质与⑤的同周期相邻主族元素的单质反应的化学方程式为________
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为________.
查看答案和解析>>
科目: 来源:江苏省盐城市2010届高三第二次调研考试化学试题 题型:022
吲哚昔酚(idoxifene)可用于治疗骨质疏松症,它的合成路线如下:
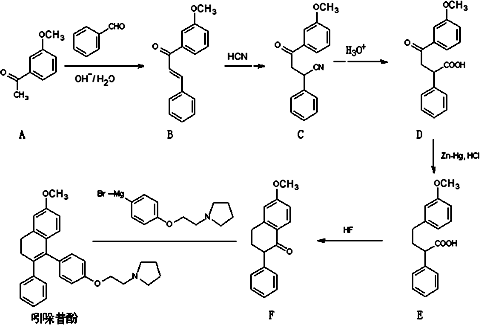
(1)反应类型:B→C________;D→E________.
(2)D中含氧官能团有:________(写名称).
(3)满足下列三个条件的A的同分异构体数目有________种.
①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;
③与FeCl3溶液作用不显色
(4)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六员环,G结构简式为:________
(5)2,2-二甲基戊酸[![]() ]是有机合成中间体,请设计合理的方案以丙酮(
]是有机合成中间体,请设计合理的方案以丙酮(![]() )为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,并注明反应条件).
)为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,并注明反应条件).
提示:①合成过程中无机试剂任选;②丙酮分子间能发生上图合成路线中A→B的类似反应;③合成路线流程图示例如下:
_______________________
查看答案和解析>>
科目: 来源:江苏省盐城市2010届高三第二次调研考试化学试题 题型:022
纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用.
(1)
制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解,其化学反应式为:________.(2)
纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是:________;通过质谱仪发现还有多种副反物,其中之一为:(3)利用半导材料TiO2与染料、铂电极及I![]() 和I-的混合物作电解质(I2+I-
和I-的混合物作电解质(I2+I-![]() I
I![]() ),可构成染料敏化太阳能电池(DSSCs)工作原理如图,该电池工作时,正极的电极反应为:________.
),可构成染料敏化太阳能电池(DSSCs)工作原理如图,该电池工作时,正极的电极反应为:________.

(4)在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20 min取一次样,实验结果如下.

下列说法正确的是________.
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO2薄膜的光催化活性不同
查看答案和解析>>
科目: 来源:江苏省盐城市2010届高三第二次调研考试化学试题 题型:022
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:

(1)铁在元素周期表中位于________周期________族
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:________(选用上图中的a、b、c、d填空)
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是________.
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:

反应④ΔH4=________kJ·mol-1.
(5)1100℃时,FeO(s)+CO(g)![]() Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2 g FeO,同时通入4.48 L CO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:________.
Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2 g FeO,同时通入4.48 L CO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:________.
查看答案和解析>>
科目: 来源:江苏省盐城市2010届高三第二次调研考试化学试题 题型:022
汞不溶于水,易挥发,易与许多金属形成合金,汞是对人体危害较大的一种金属,据统计世界上有80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们的重视,水体中的无机汞主要有Hg2+、Hg22+.
(1)实验时倘若不慎,将汞溅落地面时,可先用涂上X溶液的锌片去粘拾,然后再用足量的X溶液溶解锌片回收汞,X溶液可以是________(填试剂名称).
(2)检测水体中的Hg2+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为:________.
(3)冶金厂治理含汞、含硫的烟气并回收汞,中国冶金工作者在研究Hg-I-H2O系热力学的基础上,查明KI溶液能有效吸收汞,吸收总反应为:2Hg+SO2+8I一+4H+=2HgI![]() +S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为:________.
+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为:________.
(4)国家制定的工业废水排放标准:汞的含量≤0.05 mg/L.某合作学习小组的同学拟用硫化钠法处理含汞废水,其步骤为:先将溶液pH调至8~10,然后加入稍过量的硫化钠溶液,最后加入一定量的FeSO4溶液,过滤后排放.已知:25℃ HgS的Ksp=4×10-52;Hg2S的Ksp=1.0×10-47,FeS的Ksp=6.3×10-18;HgS+Na2S![]() Na2HgS2(易溶).
Na2HgS2(易溶).
①若操作程序完全正确,且废水中只含无机汞,上述处理后的废水能否达标排放________(选填:“能”或“不能”)
②加入FeSO4溶液的作用是________.
查看答案和解析>>
科目: 来源:江苏省盐城市2010届高三第二次调研考试化学试题 题型:022
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
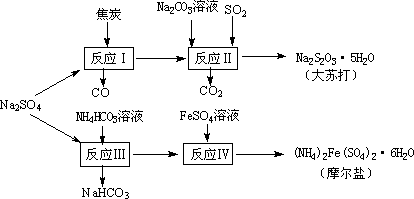
试回答下列问题:
(1)已知反应Ⅰ中发生的主要反应为:Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)ΔH=+569.99 kJ/mol,欲使该反应发生并维持该反应进行的条件是________.
(a)常温
(b)常温,并通入少量CO2
(c)高温,并通入适量的O2
(2)配平反应Ⅱ的化学方程式:□Na2S+□Na2CO3+□SO2=□Na2S2O3+□CO2________
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是________.
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO![]() 都大量减少,该物质是________.
都大量减少,该物质是________.
(5)反应Ⅳ中两种盐溶液混合时,需加入适量的H2SO4,将溶液pH调到1,用离子方程式说明原因:________
查看答案和解析>>
科目: 来源:江苏省苏北四市2010届高三下学期第二次调研考试化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com