
科目: 来源:湖北省黄冈中学2010届高三5月份第一次模拟考试理综化学部分题(A卷) 题型:022
A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则该反应的离子方程式是________.
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是________.
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中
①A元素在周期表中的位置是第________周期________族,气体Y的化学式是________.
②含a molX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量为________mol.
(4)若A、B、X、Y均为化合物.A溶于水电离出的金属阳离子水解的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1∶4恰好反应,所得溶液为无色时,该溶液中离子浓度从大到小的顺序是________________.
查看答案和解析>>
科目: 来源:2010年全国普通高等学校招生统一考试、化学(上海卷) 题型:022
白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如图所示.该结构中氯原子有两种不同位置.

(1)6.20 g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为________L.
上述燃烧产物溶于水配成50.0 mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为________mol·L-1.
(2)含0.300 mol H3PO4的水溶液滴加到含0.500 mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2 g H2O.该难溶盐的化学式可表示为___________________.
(3)白磷和氯、溴反应,生成混合卤化磷PCl5-xBrx(1≤x≤4,且x为整数).
如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为___________________.
(4)磷腈化合物含有3种元素,且分子中原子总数小于20.0.10 mol PCl5和0.10 mol NH4Cl恰好完全反应,生成氯化氢和0.030 mol磷腈化合物.推算磷腈化合物的相对分子质量(提示:M>300).
查看答案和解析>>
科目: 来源:2010年全国普通高等学校招生统一考试、化学(上海卷) 题型:022
CaCO3广泛存在于自然界,是一种重要的化工原料.大理石主要成分为CaCO3,另外有少量的含硫化合物.实验室用大理石和稀盐酸反应制备CO2气体.下列装置可用于CO2气体的提纯和干燥.
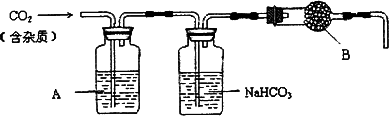
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是________.
A.烧杯
B.玻璃棒
C.量筒
D.容量瓶
(2)上述装置中,A是________溶液,NaHCO3溶液可以吸收________.
(3)上述装置中,b物质是________.用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果________(填“偏高”、“偏低”或“不受影响”).
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是________.
A.氯化钠溶液
B.稀醋酸
C.稀硫酸
d.正已烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________后溶出________.
(6)上述测定实验中,连续________,说明样品已经恒重.
查看答案和解析>>
科目: 来源:2010年全国普通高等学校招生统一考试、化学(上海卷) 题型:022
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)![]() 2SO3(g)+190KJ
2SO3(g)+190KJ
(1)该反应所用的催化剂是________(填写化合物名称),该反应450℃时的平衡常数________500℃时的平衡常数(填“大于”、“小于”或“等于”).
(2)该热化学反应方程式的意义是________.
A.v(o2)正=2v(SO3)逆
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(o2)=________mol·l-1·min-1:若继续通入0.20 mol SO2和0.10 mol O2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol.
查看答案和解析>>
科目: 来源:2010年全国普通高等学校招生统一考试、化学(上海卷) 题型:022
向盛有KL溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
![]()
(2)整个过程中的还原剂是________.
(3)把KL换成KBr,则CCl4层变为________色:继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是________.
(4)加碘盐中含碘量为20 mg~50 mg/kg.制取加碘盐(含KIO3的食盐)1000 kg,若庄Kl与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数).
查看答案和解析>>
科目: 来源:2010年全国普通高等学校招生统一考试、化学(上海卷) 题型:022
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物.
(1)三硅酸镁的氧化物形式为________,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为________.
(2)铝元素的原子核外共有________种不同运动状态的电子、________种不同能级的电子.
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径________(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:________
(4)ALO3、Mg0和SiO2都可以制耐火材料,其原因是________.
A.ALO3、Mg0和SiO2都不溶于水
B.ALO3、Mg0和SiO2都是白色固体
C.ALO3、Mg0和SiO2都是氧化物
D.ALO3、Mg0和SiO2都有很高的熔点
查看答案和解析>>
科目: 来源:江苏省泰州南通2010届高三第三次模拟考试化学试题 题型:022
已知:
A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.请回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是
________(填元素符号).(2)
B的氢化物的沸点远高于A的氢化物的主要原因是________.(3)
由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为________.(4)E2
+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有________.(5)
最近发现,只含A、D、E三种元素的一种晶体(晶胞如图所示)具有超导性.A原子的配位数为________;该晶体的化学式为________.
查看答案和解析>>
科目: 来源:江苏省泰州南通2010届高三第三次模拟考试化学试题 题型:022
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)烟气脱硫、脱硝的环境意义是________.
(2)选择性催化还原法的脱硝原理为:
6NOx+4xNH3![]() (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3 mol电子,生成标准状况下N2的体积为________L.
②
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5 kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=________.
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
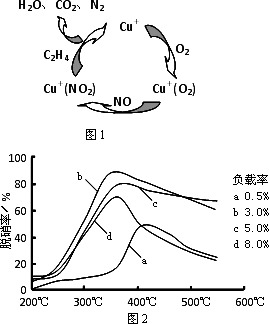
①写出该脱硝原理总反应的化学方程式:________.
②为达到最佳脱硝效果,应采取的条件是________.
查看答案和解析>>
科目: 来源:江苏省泰州南通2010届高三第三次模拟考试化学试题 题型:022
下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物.
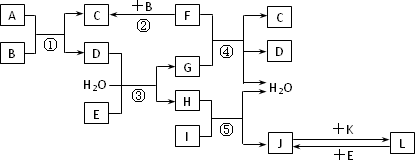
请回答下列问题:
(1)C的电子式为________.
(2)检验溶液L中金属阳离子的方法是________.
(3)反应③的离子方程式为________.
(4)F与G的浓溶液反应的化学方程式为________.
(5)气体A的密度为2.68 g·L-1(标准状况),通过计算、推理,可确定A的分子式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com