
科目: 来源:山东省潍坊市第一中学2011届高三教学质量检测化学试题 题型:022
氧化还原反应中实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3-+4H++3e-→NO↑+2H2O.
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生.请回答:
(1)写出该氧化还原反应的化学方程式(不必配平):________.
(2)反应中硝酸表现出________、________的性质.
(3)反应中若产生4.48 L(标准状况)气体,则转移电子的物质的量是________mol.
(4)硝酸浓度不同,与甲反应的产物不同.若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:________.
查看答案和解析>>
科目: 来源:山东省潍坊市第一中学2011届高三教学质量检测化学试题 题型:022
A、B、C、D、E均为可溶于水的固体,组成它们的离子有:
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀和无色气体,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失.
请回答:
(1)写出物质的化学式:B________,D________.
(2)写出相应的离子方程式:
Ⅰ.A溶液与C溶液反应:________.
Ⅱ.A溶液与少量E反应:________.
查看答案和解析>>
科目: 来源:山东省潍坊市第一中学2011届高三教学质量检测化学试题 题型:022
有X、Y、Z、V、W五种短周期元素,已知:
①Z+、V3+均与W的气态氢化物分子具有相同的电子数;X2-、Y-与Y的气态氢化物分子具有相同的电子数;
②X单质在空气中燃烧产生气体R;
③Y的气态氢化物与W的气态氢化物相遇时有白烟生成.
请回答:
(1)X2-的结构示意图为________.
(2)元素W在元素周期表中的位置是________.
(3)元素Z的单质在空气中燃烧产物的化学式为________.
(4)元素Z的最高价氧化物的水化物是一种强碱,写出元素V的单质与该强碱溶反应的化学方程式:________.
(5)向Y单质的水溶液中通入过量气体R的现象为________;
反应的离子方程式为________.
查看答案和解析>>
科目: 来源:山东省实验中学2011届高三第二次诊断性测试化学试题 题型:022
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) △H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
2NO2(g) △H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
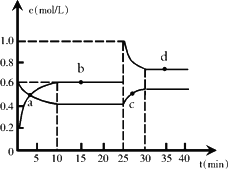
(1)该温度时,该反应的平衡常数为________,若温度升高,K值将________(填“增大”、“减小”或“不变”).
(2)a、b、c、d四个点中,化学反应处于平衡状态的是________点.从起点开始首次达到平衡时,以NO2表示的平均反应速率为________.
(3)25 min时,增加了________mol________(填物质的化学式)使平衡发生了移动.
(4)d点对应NO2的物质的量浓度________(填“>”、“<”或“=”)0.8 mol·L-1,理由是________.
查看答案和解析>>
科目: 来源:山东省实验中学2011届高三第二次诊断性测试化学试题 题型:022
(1)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=2NO2(g) △H=67.7 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543 kJ·mol-1
![]() H2(g)+
H2(g)+![]() F2(g)=HF(g) △H=-269 kJ·mol-1
F2(g)=HF(g) △H=-269 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-242 kJ·mol-1
O2(g)=H2O(g) △H=-242 kJ·mol-1
①肼和NO2反应的热化学方程式为:________.
②有人认为若用氟气代替NO2作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为:________.
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高.一个电极通入空气,另一个电极通入汽油蒸汽.其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子.以戊烷(C5H12)代表汽油,完成下列问题:
①电池反应方程式为________;
②放电时固体电解质里的O2-离子的移动方向是向________极移动(填“正”或“负”).
查看答案和解析>>
科目: 来源:山东省罗美中学2011届高三11月月考化学试题 题型:022
下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336 mL(标准状态)气体.回答:
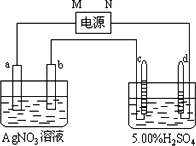
(1)直流电源中,M为________极.
(2)写出c极上发生的电极反应式________.
(3)Pt电极上生成的物质是________,其质量为________g.
(4)AgNO3溶液的浓度(填增大、减小或不变.)________,H2SO4溶液的浓度________.(同上)
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g.
查看答案和解析>>
科目: 来源:山东省罗美中学2011届高三11月月考化学试题 题型:022
在常温下,下列五种溶液:
①0.1 mol/L NH4Cl
②0.1 mol/L CH3COONH4
③0.1 mol/L NH4HSO4
④0.1 mol/L NH3·H2O和0.1 mol/L·NH4Cl混合液
⑤0.1 mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈________性(填“酸”、“碱”或“中”),其原因是________(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是________;c(NH![]() )最小的是________(填序号)
)最小的是________(填序号)
(3)比较溶液②、③中c(NH![]() )的大小关系是②________③(填“>”、“<”或“=”)
)的大小关系是②________③(填“>”、“<”或“=”)
(4)在溶液④中,________离子的浓度为0.1 mol/L;NH3·H2O和________离子的物质的量浓度之和为0.2 mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”)NH![]() 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH![]() 浓度的大小关系是:c(CH3COO-)________c(NH
浓度的大小关系是:c(CH3COO-)________c(NH![]() )(填“>”、“<”或“=”)
)(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:山东省罗美中学2011届高三11月月考化学试题 题型:022
现有A.B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:
①A.B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:________.
(2)写出E溶液与过量的B溶液反应的离子方程式________.
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-aKJ·mol-1.请写出B与C的稀溶液反应的热化学方程式________.
(4)在100 mL 0.1 mol·L-1E溶液中,逐滴加入35 mL 2 mol·L-1 NaOH溶液,最终得到沉淀物质的量为________.
查看答案和解析>>
科目: 来源:山东省罗美中学2011届高三11月月考化学试题 题型:022
373 K时,某1 L密闭容器中发生如下可逆反应:
A(g)![]() 2B(g).其中物质B的物质的量变化如下图所示
2B(g).其中物质B的物质的量变化如下图所示
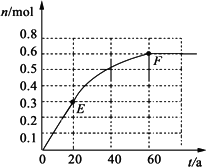
(1)已知373 K时60 s达到平衡,则前60 s内A的平均反应速率为________.
(2)该反应的平衡常数表达式为________.
(3)若在此平衡体系中再加入amol的A,反应速率________(填“增大”或“减小”,下同),平衡时A的转化率________.A的平衡浓度________.
(4)若373 K时B的平衡浓度为A的2倍,473 K时(其他条件不变),B的平衡浓度为A的3倍,该反应的正反应为________(填“放热反应”或“吸热反应”),为使该反应的平衡常数变小,可以采取的措施是________.
a.升高温度
b.扩大容器的体积
c.降低温度
d.将B从体系中抽走
查看答案和解析>>
科目: 来源:宁夏银川二中2011届高三第三次月考化学试题 题型:022
含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO![]() 还原为N2,从而消除污染.其反应的离子方程式是:
还原为N2,从而消除污染.其反应的离子方程式是:
6NO![]() +10Al+18H2O
+10Al+18H2O![]() 3N2↑+10Al(OH)3+6OH-
3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下11.2 L氮气时,转移的电子为________mol.现在要除去1 m3含氮元素0.4 mol的废水中的NO![]() (设氮元素都以NO
(设氮元素都以NO![]() 的形式存在,下同),则至少需要消耗金属铝________g.
的形式存在,下同),则至少需要消耗金属铝________g.
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同.
①写出镁和含氮废水反应的离子方程式________
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为________,若要除去1 m3含氮元素0.3 mol的废水中的NO![]() ,则至少需要含0.5%(质量分数)MgCl2的海水________kg.
,则至少需要含0.5%(质量分数)MgCl2的海水________kg.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com