
科目: 来源:江西省师大附中、临川一中2011届高三12月联考化学试题 题型:022
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)选择性催化还原法的脱硝原理为:
6NOx+4xNH3![]() (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3 mol电子,生成标准状况下N2的体积为________L.
②已知:2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g)
ΔH=-180.5kJ·mol-1则反应6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)的ΔH=________.
5N2(g)+6H2O(g)的ΔH=________.
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
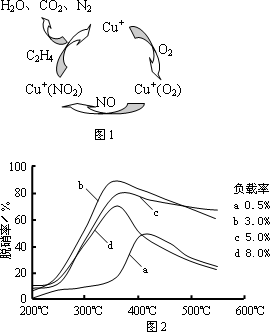
①出该脱硝原理总反应的化学方程式:________.
②为达到最佳脱硝效果,应采取的条件是________.
查看答案和解析>>
科目: 来源:江西省师大附中、临川一中2011届高三12月联考化学试题 题型:022
下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物.
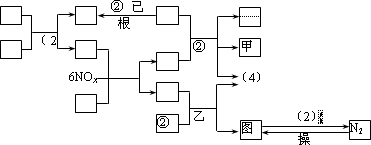
请回答下列问题:
(1)C的电子式为________.
(2)检验溶液L中金属阳离子的方法是________.
(3)反应③的离子方程式为________.
(4)F与G的浓溶液反应的化学方程式为________.
(5)气体A的密度为2.68 g·L-1(标准状况),通过计算、推理,可确定A的分子式为________.
查看答案和解析>>
科目: 来源:江西省师大附中、临川一中2011届高三12月联考化学试题 题型:022
物质X、Y是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应.
①若X为氧化物,X的化学式是________.
②若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B.等物质的量的A和B在水溶液中反应又生成X.
X与足量稀氢氧化钠溶液反应的离子方程式是________.
③若X为金属单质,写出X与氢氧化钠溶液反应的化学方程式________;若Y为非金属单质,Y不能与浓、稀硫酸反应,却能与某种酸反应放出氢气,并与氢氧化钠溶液反应放出氢气.写出Y与氢氧化钠溶液反应的化学方程式并用单线桥法标明电子的转移________.
查看答案和解析>>
科目: 来源:江西省南昌市铁路一中2011届高三12月月考化学试题 题型:022
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
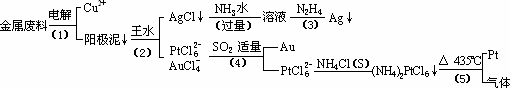
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:________
阴极:________;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:________;
(3)写出步骤(4)的离子反应方程式:________;
(4)金和浓硝酸反应的化学方程式为:
Au+6HNO3(浓)![]() Au(NO3)3+3NO2↑+3H2O
Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:________.
查看答案和解析>>
科目: 来源:江西省南昌市铁路一中2011届高三12月月考化学试题 题型:022
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅.
(1)如图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________.
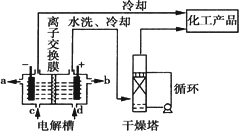
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注.
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为________.
②SiCl4可转化为SiHCl3而循环使用.一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(g)![]() 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0
.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg.(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213
.0 kg,则生成氢气________m3(标准状况).查看答案和解析>>
科目: 来源:江西省南昌市铁路一中2011届高三12月月考化学试题 题型:022
X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示).
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________.
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________.该族2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号).
A.+99
.7 mol·L-1B.+29
.7 mol·L-1C.-20
.6 mol·L-1D.-241
.8 kJ·mol-1(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:________;由R生成Q的化学方程式:________.
查看答案和解析>>
科目: 来源:江西省南昌市铁路一中2011届高三12月月考化学试题 题型:022
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小.
(1)A2B和A2D的沸点较高者是________(填化学式),其原因是________;
(2)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液.接通电源一段时间后,________极(填电极名称)附近出现红色;另一极的电极反应式为________,可用________检验该极所得产物.电解的总反应方程式为________.
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期中考试化学试题 题型:022
已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物.现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质,
(1)请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式________;
(2)上述所写反应中,硝酸表现出的化学性质是________,被还原的元素是________.
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是________(填化学式),若该反应中NH4NO3与N2O物质的量之比为1∶1,那么该反应中氧化剂与还原剂的物质的量之比为________.
查看答案和解析>>
科目: 来源:河南省豫南九校2010-2011学年高三第二次联考化学试题 题型:022
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.
(1)下图是1 mol NO2气体和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式:________.
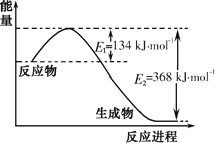
(2)已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ/mol
N2(g)+O2(g)=2NO(g)
ΔH=+180 kJ/mol则反应
2NO(g)+2CO(g)(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g);ΔH<0,其平衡常数K与温度T的关系如下表:
2NH3(g);ΔH<0,其平衡常数K与温度T的关系如下表:

①写出该反应的平衡常数表达式:K=________.
②试判断K1________K2(填写“>”“=”或“<”)
③下列各项能说明该反应一定达到平衡状态的是________(填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(H2)(逆)=3v(N2)(正)
c.容器内压强保持不变
d.混合气体的密度保持不变
④若上述反应达到平衡时,N2、H2、NH3的浓度之比为1∶3∶2,再向容器中按物质的量之比为1∶3∶2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度________(填增大、不变或减小,下同),NH3的体积分数________.
查看答案和解析>>
科目: 来源:河南省豫南九校2010-2011学年高三第二次联考化学试题 题型:022
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,在所有元素中A的原子半径最小,B原子最外层电子数是次外层的2倍.A、E同主族,D、F同主族,且D、F的原子序数之和为A、E的原子序数之和的2倍,请回答下列问题:
(1)写出下列元素的名称:C________ E________;
(2)A、C能形成多种化合物,其中C2A4的结构式为________(用元素符号回答,下同);
(3)化合物E2D2中存在的化学键类型为________;
(4)由A、D、E、F四种元素形成的两种化合物,在水溶液中两者反应的离子方程式为________;
(5)B的单质可与A、D、F形成化合物的浓溶液反应,为检验所有生成物,被检验物质的顺序依次为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com