
科目: 来源:浙江省宁波市2011届高三上学期期末试题化学试题 题型:022
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(l).其工作原理示意图如下:
CO2(g)+2H2O(l).其工作原理示意图如下:

请回答下列问题:
(1)写出甲图中b、c两个入口通入的物质名称(或化学式)b________c________
(2)负极的电极反应式为________.
(3)用该原电池电解AgNO3溶液,若Fe电极增重5.4 g,则燃料电池在理论上消耗的氧气的体积为________mL(标准状况)
查看答案和解析>>
科目: 来源:浙江省宁波市2011届高三上学期期末试题化学试题 题型:022
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:

(1)混合物中是否存在FeCl2________(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4________(填“是”或“否”),你的判断依据是________.
(3)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)________
(4)把AlCl3溶液加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3·6H2O晶体.________
查看答案和解析>>
科目: 来源:浙江省宁波市2011届高三上学期期末试题化学试题 题型:022
一
种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 和Cl-,取该溶液进行如下实验:
和Cl-,取该溶液进行如下实验:
①将溶液滴在pH试纸上,呈红色.
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体遇空气则立即变成红棕色.
③取少许溶液滴入BaCl2试液,则产生白色沉淀.
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀.
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断,原溶液中肯定不存在的离子是________;肯定存在的离子是________.
查看答案和解析>>
科目: 来源:福建省福州市2011届高三上学期期末质量检查化学试题 题型:022
在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH<0.CO和H2O浓度变化如下图:
CO2(g)+H2(g);ΔH<0.CO和H2O浓度变化如下图:
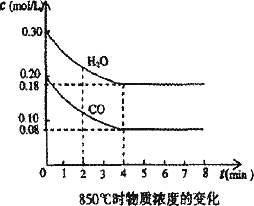
(1)0-4 min的平均反应速率v(CO)=________mol/(L·min).
(2)850℃时,平衡常数K=________.
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为________.
(4)能判断该反应达到化学平衡状态的依据是________(填选项序号).
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
科目: 来源:福建省福州市2011届高三上学期期末质量检查化学试题 题型:022
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO.
(1)Ca元素原子结构示意图________,Ca(OH)2碱性比Mg(OH)2________(填“强”或“弱”).
(2)Ca与非金属最强的元素A形戒化合物D,D的电子式为________.
(3)配平用钙线脱氧脱鳞的化学方程式:P+FeO+CaO Ca3(PO4)2+Fe
Ca3(PO4)2+Fe
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n.则金属M为________(填元素符号);检测Mn+最常用的试剂是________(填化学式).
(5)取1.6 g钙线试样,与水充分反应,生成224 mL H2(标准状况),在所得溶液中通入适量的CO2,最多能得到CaCO3________g.
查看答案和解析>>
科目: 来源:江西省南昌三中2011届高三第六次月考化学试题 题型:022
Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.已知:X+Y![]() Z+W
Z+W
(1)Y的电子式是________.
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是________.
(3)用下图示装置制备NO并验证其还原性.有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中.
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞.
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸.
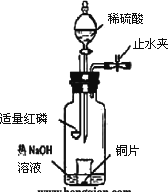
①步骤c后还缺少的一步主要操作是________.
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是________.
③步骤c滴入稀硝酸后烧杯中的现象是________.反应的离子方程式是________.
查看答案和解析>>
科目: 来源:江苏省苏北四市2011届高三第二次调研考试化学试题 题型:022
从废钯催化剂(该催化剂的载体为活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
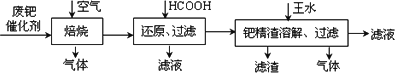
将最后所得到的滤液,经过一定的操作后可得到海棉钯.
(1)废钯催化剂经烘干后,再在800℃的高温下焙烧,焙烧过程中需通入足量空气的原因是________;焙烧时钯转化为氧化钯(PdO),则甲酸还原氧化钯的化学方程式为________.
(2)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯精渣的适宜条件为________、________、________.
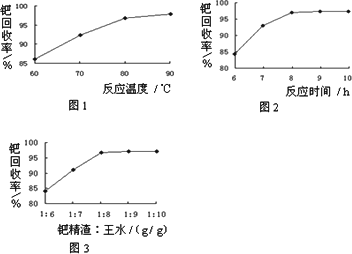
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,王水溶解钯精渣的过程中有化合物A和一种无色、有毒气体B生成,并得到滤渣.
①气体B的分子式:________;滤渣的主要成分是________.
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%,则A的化学式为________.
查看答案和解析>>
科目: 来源:江苏省苏北四市2011届高三第二次调研考试化学试题 题型:022
燃煤废气中的氮氧化物(
NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
则
CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为________.(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:

①若温度升高,则反应的平衡常数K将________(填“增大”、“减小”或“不变”.下同);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________.
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式________.
③在②所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜________g.
查看答案和解析>>
科目: 来源:海南省嘉积中学2011届高三质量检测(四)化学试题 题型:022
水的电离平衡如图所示:
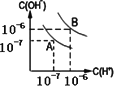
(1)若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点.则此时水的离子积从________增加到________.
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃时的恒温,于是混合物溶液的pH=7,则Ba(OH)2与盐酸溶液的体积比________
(3)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是________
查看答案和解析>>
科目: 来源:福建省泉州一中2011届高三上学期期末考试化学试题 题型:022
电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:

①若a为CuSO4溶液,则电解时的化学反应方程式为________.通过一段时间后,向所得溶液中加入0.2 mol CuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________.
②若电解含有0.04 mol CuSO4和0.04 mol NaCl的混合溶液400 ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH=________(假设电解后溶液体积不变).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com