
科目: 来源:2011年高考化学总复习30分钟限时训练:专题5 物质结构元素周期律 题型:022
类推法是科学学习的重要方法之一.在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质.请结合元素周期律完成下列问题:

(1)硒的熔点范围可能是________.
(2)碲的化合价可能有________.
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________(填化学式).
(4)氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为________.
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:________Al2Te3+
(________)→Al(OH)3↓+H2Te↑
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题5 物质结构元素周期律 题型:022
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:

回答下列问题:
(1)写出下列元素的名称:C________,E________.
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)________.
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式:________.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题3 金属及其化合物 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题23 氧化还原反应与离子反应 题型:022
已知:2Fe3++2I- 2Fe2++I2
2Fe2++I2
2Fe2++Br2 2Fe3++2Br-
2Fe3++2Br-
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________.
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是________.
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c________(用含a、b的代数式表示).
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题23 氧化还原反应与离子反应 题型:022
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________.
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为________.
(3)根据上述反应可推知________.
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3ASO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:

查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题23 氧化还原反应与离子反应 题型:022
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是________

查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题19 硫及其化合物 题型:022
“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.
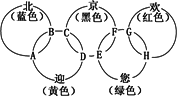
已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1 mol G可与1 mol“您”恰好反应生成1 mol H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅炼可制得A,此反应是工业上制取酸M的基础反应.请回答下列问题:
(1)“京”是________,“欢”的同素异形体是________.
(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:________,该反应为氧化还原反应,还原产物为________.
(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气得到一种化肥,写出该肥料的化学式:________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题19 硫及其化合物 题型:022
某待测溶液中可能含有SO![]() 、SO
、SO![]() 、CO
、CO![]() 、Cl-、NO
、Cl-、NO![]() 、HCO
、HCO![]() 、S2-等离子,进行下列实验如图所示[所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量].
、S2-等离子,进行下列实验如图所示[所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量].
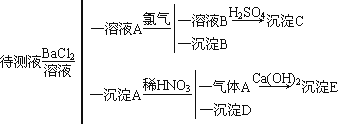
(1)判断待测溶液中有无SO![]() 、SO
、SO![]() ,并说明理由________.
,并说明理由________.
(2)沉淀B为________.
(3)沉淀A可能是________.
(4)写出生成沉淀B的离子方程式:________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题18 氯及其化合物 题型:022
(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,这是因为________,反应的离子方程式是________.
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,这是因为________,反应的离子方程式是________.
(3)对比(1)和(2)实验所得的结果,将Cl-、I-、SO2按还原性由强到弱顺序排列为________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题17 硅及其化合物 题型:022
往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示.试解答下列问题:
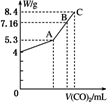
(1)A点时,白色固体M的化学式为________,通入的CO2的体积为________ mL(标准状况下,下同).
(2)C点时,白色固体M的化学式为________,通入的CO2的体积为________mL.
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________mL.
(4)该NaOH溶液的物质的量浓度为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com