
科目: 来源:2011年高考化学总复习30分钟限时训练:专题9 电化学基础 题型:022
Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2 4LiCl+S+SO2.
4LiCl+S+SO2.
请回答下列问题:
(1)电池的负极材料为________,发生的电极反应为________;
(2)电池正极发生的电极反应为________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,实验现象是________,
反应的化学方程式为________;
(4)组装该电池必须在无水、无氧的条件下进行,原因是________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题9 电化学基础 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题9 电化学基础 题型:022
将铝件与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部分存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜.某校课外兴趣小组根据上述原理,以铝件和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验.
(1)铝件表面形成Al(OH)3的电极反应式是:________.
(2)电解过程中,必须使电解液pH保持相对稳定(不能太大,也不能太小)的原因是________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题9 电化学基础 题型:022
用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如图所示.
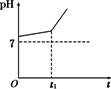
(1)在0→t时间内,两个电极上的电极反应式为:
阳极:________;
阴极:________.
(2)用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因:________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题8 溶液中的离子平衡 题型:022
水的电离平衡曲线如下图所示.
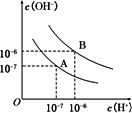
(1)若以A点表示25°C时水在电离平衡时的离子浓度,当温度升高到100°C时,水的电离平衡状态到B点,则此时水的离子积从________增加到________.
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为________.
(3)已知AnBm的离子积为cn(Am+)×cm(Bn-),若某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/cm3,其离子积约为________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题8 溶液中的离子平衡 题型:022
由一价离子组成的四种盐溶液:AC、BD、AD、BC,浓度均为0.1 mol·L-1.在室温下,前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7.下列各组酸、碱性比较正确的是________

查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题5 物质结构元素周期律 题型:022
已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:
(1)A的元素符号为________,C的氢化物的化学式为________.
(2)为比较C与D的单质的氧化性强弱,可设计实验以证实,则该实验所依据的反应的化学方程式为________.
(3)1 mol C的氢化物与足量C的氧化物反应,转移的电子的物质的量为________mol.
(4)已知E、G、F是均含有B元素的化合物,其有关转化关系如下:
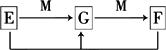
请写出E与F反应生成G的离子方程式________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题5 物质结构元素周期律 题型:022
X、Y、Z是三种原子序数小于18的元素,甲、乙、丙为化合物,其转化关系如下:
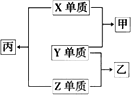
请回答:
(1)欲实现上图的转化,在X、Y、Z中最多有________种是金属元素.
(2)若甲、乙分子中均含有10个电子,且甲分子中含有3个原子,乙分子中含有4个原子,则乙是________,丙是________.
(3)若甲和单质Z均为淡黄色固体,则甲和水反应的化学方程式为________;
甲和乙之间发生反应生成的固态产物可能是:________,或________,或________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题5 物质结构元素周期律 题型:022
现有a~h8种短周期元素,它们在元素周期表中的位置如下,请据此回答下列问题:
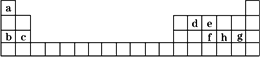
(1)下列中的元素的原子间反应最容易形成离子键的是________,容易形成共价键的是________.
A.c和f
B.b和g
C.d和g
D.b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是________.
A.ea3
B.ag
C.fg3
D.dg4
(3)由a、e组成的一种化合物化学式为ea5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式________,该物质属于________(填“离子”或“共价”)化合物.
(4)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体.这两种化合物中有一种相对分子质量为120,该化合物熔化时破坏的是________,溶于水时破坏的是________(填化学键类型).
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题5 物质结构元素周期律 题型:022
已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.
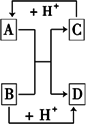
(1)如果A、B、C、D均是10电子的粒子,请写出:A的结构式________,D的电子式________.
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式________.
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________.
(3)已知肼(H2N-NH2)和甲胺(CH3-NH2)都是18个电子的分子.分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com