
科目: 来源:湖北省荆州中学2012届高三第一次质量检查化学试题 题型:022
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1.请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________;
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
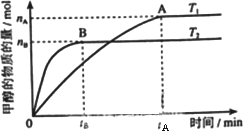
下列说法正确的是________(填序号,错选倒扣分)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:
v(CH3OH)=nA/tAmol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(3)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为________;
(4)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________.理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
查看答案和解析>>
科目: 来源:湖北省荆州中学2012届高三第一次质量检查化学试题 题型:022
氮元素可以形成多种化合物.
回答以下问题:
(1)基态氮原子的价电子排布式是________.
(2)C、N、O三种元素第一电离能从大到小的顺序是________.
(3)肼(N2H4)分子可视为NH3 分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮化物.
①NH3分子的空间构型是________;N2H4分子中氮原子轨道的杂化类型是________.
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1
若该反应中有4 mol N-H键断裂,则形成的π键有________mol.
③肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a.离子键
b.共价键
c.配位键
d.范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体得4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.下列分子或离子中,能被该有机化合物识别的是________(填标号).

a.CF4
b.CH4
c.NH4+
d.H2O
查看答案和解析>>
科目: 来源:浙江省台州中学2012届高三上学期第一次统练化学试题 题型:022
已知元素A、B、C、D、E的原子序数依次递增.A与D相邻,D元素的M层电子数是其K层电子数的2倍,C元素的最外层电子数是其电子层数的3倍,E的原子序数为29.请回答下列问题:
(1)下列有关说法正确的是________
①D的单质常可制取光导纤维;
②DC2属于分子晶体;
③第一电离能:B>C>A>D
④基态E2+的核外电子排布式为:1s22s22p63s23p63d9
⑤BH3分子的空间构型为三角锥形
(2)写出与B2分子电子总数相等的分子(要求写2个)________;
(3)A与氢原子形成的相对分子质量为28的化合物分子,一个分子中有________个σ键;
(4)A、B两种元素形成的简单氢化物中,沸点较高的是________(填物质名称),其主要原因是________;
查看答案和解析>>
科目: 来源:辽宁省抚顺市六校联合体2011届高三一模考试化学试题 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:辽宁省抚顺市六校联合体2011届高三一模考试化学试题 题型:022
短周期元素A、B、C、D原子序数依次增大,A是元素周期表中原子半径最小的元素,A、C同主族,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等.
(1)化合物C2B2中含有的化学键类型为________.
(2)化合物CDB是家用消毒剂的主要成分,其水溶液显碱性.显碱性的原因用离子方程式表示为________.
(3)往CD溶液中滴加硝酸银溶液生成白色沉淀后,再滴加碘化钠溶液,可观察到的现象是________.[已知:KSP(AgCl)>KSP(AgI)]
查看答案和解析>>
科目: 来源:江西省白鹭洲中学2012届高三第一次月考化学试题 题型:022
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
![]()
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B________ D________
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为________.
(3)在A溶液中加少入量澄清石灰水,其离子方程式为________.
(4)C常用作净水剂,用离子方程式表示其净水原理________.
查看答案和解析>>
科目: 来源:江西省白鹭洲中学2012届高三第一次月考化学试题 题型:022
将
NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+________MnSO4+________H2SO4-________Na2SO4+________Bi2(SO4)3+________NaMnO4+________H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是________.
查看答案和解析>>
科目: 来源:2011年普通高等学校招生全国统一考试化学试题江苏卷 题型:022
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
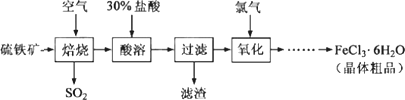
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为________.
2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是________、________.
(3)通氯气氧化后时,发生的主要反应的离子方程式为________;该过程产生的为其可用碱溶液吸收,为其中污染空气的气体为________(写化学).
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题9 电化学基础 题型:022
利用太阳光分解水制氢是未来解决能源危机的理想方法之一.某研究小组设计了如图所示的循环系统实现光分解水制氢.反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用.
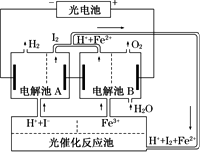
(1)写出下列反应中的离子方程式:
电解池A:________;
电解池B:________;
光催化反应池:________.
(2)若电解池A中生成3.36 L H2(标准状况),电解池B中生成Fe2+的物质的量为________.
(3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol/L和b mol/L,光催化反应生成Fe3+的速率为c mol/min,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积).试用所给字母的代数式表示溶液的流量Q=________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com