
科目: 来源:江苏省无锡一中2012届高三9月初检测试题化学试题 题型:022
工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料.

(1)聚合物F的结构简式是________;
(2)D转化为E的化学方程式是________;A转化为B的反应类型是________.
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是________.
(4)写出3种含有一个羟基、一个酯基的E的同分异构体的结构简式:
________、________、________.
查看答案和解析>>
科目: 来源:江苏省无锡一中2012届高三9月初检测试题化学试题 题型:022
近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题.
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液.
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸.
(Ⅲ)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用.
写出步骤(Ⅰ)反应的化学方程式:
写出步骤(Ⅱ)中电解饱和食盐水的化学方程式:
③写出步骤(Ⅲ)反应的离子方程式:
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用.某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率.

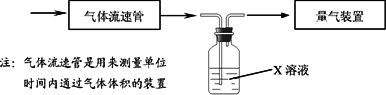
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是________.(填写序号)
A.碘的淀粉溶液
B.酸性高锰酸钾溶液
C.氢氧化钠溶液
D.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据有________、________.
查看答案和解析>>
科目: 来源:江苏省无锡一中2012届高三9月初检测试题化学试题 题型:022
(1)一个体重50 kg的健康人身体中含铁2 g.铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在.Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁(FeSO4).服用维生素C,可使食物中的Fe3+转化为Fe2+,利于铁的吸收.人体中经常进行Fe2+和Fe3+的转化,反应中,Fe2+作________剂,Fe3+作________剂.“服用维生素C,可使食物中的Fe3+转化为Fe2+”,说明维生素C在反应中做________剂,具有________性.
(2)在热的稀硫酸溶液中溶解了11. 4 g FeSO4.当加入50 mL 0.5 mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出.
FeSO4+________KNO3+________H2SO4=________K2SO4+________Fe2(SO4)3+________NxOy+________H2O
①配平该化学方程式,用单线桥标出电子转移的方向和数目.
②反应中氧化剂为________,x=________,y=________
(3)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应.则在上述反应中,羟胺的氧化产物是________.
查看答案和解析>>
科目: 来源:新人教版2012届高三上学期单元测试(6)化学试题 人教版 题型:022
现正开始使用一种安全气袋以防止汽车撞车时在驾驶室的人因向前冲撞发生意外.这种气袋内装有一种能在高温下分解出气体的混合物.例如有一种配方为:
61%-68% NaN3(叠氮化钠)、0%-5% NaNO3、0%-5%陶土、23%-28% Fe2O3粉、1%-2% SiO2粉、2%-6%石墨纤维.这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前.撞车时,约在10毫秒(10-3秒)内引发下列反应:2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲.在以后的100~200毫秒内气体“消失”,所以不致使人反弹,同时袋内的钠变成氧化钠.
(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方里哪些物质和起什么作用________.
(2)若气袋内放300 g NaN3,在充满氮气时,袋内气体体积为(1大气压,300 K)________L.若袋内气体压力达到4大气压(此时为350 K),则袋内气体体积为________L.
(3)配方中Fe2O3的量是如何控制的________.
(4)叠氮离子中有三个氮原子连成直线,N-N键等长(116 pm).写出其电子式________.
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸________.
查看答案和解析>>
科目: 来源:新人教版2012届高三上学期单元测试(5)化学试题 人教版 题型:022
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________.
(2)步骤二中“连续搅拌”的目的是________;步骤三中洗涤干净的标准是________.
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4![]() MnFe2O4-x+
MnFe2O4-x+![]() O2↑ MnFe2O4-x+xH2O→MnFe2O4+xH2↑
O2↑ MnFe2O4-x+xH2O→MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中X=0
.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________.②该热化学循环制氢的优点有(答两点即可)________.
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是________.
查看答案和解析>>
科目: 来源:新人教版2012届高三上学期单元测试(5)化学试题 人教版 题型:022
A、B、C、D、E是中学化学中常见的五种化合物,它们分别由两种元素组成.甲、乙、丙、丁是单质,甲、丙、A、C、D常温下均为气体,B是液体,E是黑色固体,这些单质和化合物之间存在如下关系(反应条件均无注明):

(1)写出下列物质的分子式:甲________、B________.
(2)在以上有关转化的反应中充当还原剂的物质有________(填写化学式).
(3)写出化合物A的电子式:________.
(4)写出单质丁跟化合物B反应生成化合物E的化学方程式.
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(6)化学试题 题型:022
在标准状况下进行甲、乙、丙三组实验,各取30.00 mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:?

请计算:?
(1)盐酸的物质的量浓度________.
(2)合金中镁与铝的物质的量的比值________.
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(6)化学试题 题型:022
已知:在常温常压下,A、B、C、D是四种气体,W、J、X、Y、Z是五种固体,其中Z是Y和W的混合物.已知W的阴、阳离子的电子层结构完全相同,各物质间的转化关系如下:

(1)写出化学式:X________;A________;B ________;
(2)W的电子式为:________;
(3)写出X+Y的化学反应方程式:________;
写出Z→C的化学反应方程式:________.
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(5)化学试题 大纲版 题型:022
一定量的氢气在氯气中燃烧,所得混合物用
100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol.(1)原NaOH溶液的质量分数为________.
(2)所得溶液中Cl-的物质的量为________mol.
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)________.
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(5)化学试题 大纲版 题型:022
某石灰厂利用本地资源石灰石
(所含杂质高温不分解,也不与酸反应),在石灰窑内高温煅烧生产生石灰.取煅烧后的样品5.92 g,与25.0 mL盐酸恰好完全反应,放出二氧化碳44.8 mL(标准状况),滤出残渣0.120 g.请计算:(1)石灰石中碳酸钙的分解率________.
(2)所用盐酸的物质的量浓度________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com