
科目: 来源:安徽省师大附中2012届高三第四次模拟考试化学试题 题型:022
组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有________(写元素符号),它的基态原子核外电子排布式是________,其第一电离能比O的________(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置________.
(2)CO2是一种温室气体,它的电子式为________,将其转变其他化工原料,必须破坏的化学键属于________(填“极性”或“非极性”)键.
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是________(填序号).
a.离子半径:S2->Na+>O2->H+
b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3
d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:

根据表中数据,归纳共价键键能与键长的关系________.
查看答案和解析>>
科目: 来源:安徽省师大附中2012届高三第四次模拟考试化学试题 题型:022
NaBH4(硼氢化钠)是典型的离子化合物,在有机反应中可将醛、酮变为醇.
(
1)硼氢化钠与水反应的离子方程式是BH4-+2H2O=BO2-+4H2↑,该反应中氧化剂是________,生成1 mol H2时转移电子的数目是________.(2)
已知HBO2是弱酸,溶液的酸性对硼氢化钠与水的反应速率有影响,酸性越强,其反应速率越________,这是因为________.(
3)硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应,反应在________(填“酸性”“中性”或“碱性”)条件下进行,试完成并配平金离子(Au3+)被硼氢化钠还原的离子方程式:________Au3++________BH4-+________=________Au↓+________BO2-+________.查看答案和解析>>
科目: 来源:浙江省杭州高级中学2012届高三第三次月考化学试题 题型:022
虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功.直到1986年,化学家Karl Christe首次用化学方法制得了F2.他提出的三步反应如下(反应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+________+H2O
②SbCl5+HF→SbF5+________
③2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为________,为什么填这一物质,试用氧化还原反应理论解释________.
(2)完成反应②:________.
(3)反应③中的氧化剂为________,被氧化的元素为________.
(4)配平反应①,并标出电子转移的方向和数目.(将答案写在下面空格上)________.
查看答案和解析>>
科目: 来源:浙江省杭州高级中学2012届高三第三次月考化学试题 题型:022
下图为常温下向25 mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液过程中溶液pH的变化曲线.

回答下列问题:
(1)上图能确定MOH为________(“强”或“弱”)碱,理由是________.
(2)上图能确定HA为________(“强”或“弱”)酸,理由是________.
(3)在D点时,溶液中c(A-)+c(HA)________2c(M+).(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:浙江省杭州高级中学2012届高三第三次月考化学试题 题型:022
在100℃和200 kPa的条件下,反应aA(g) bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
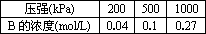
根据表中的数据,回答下列问题:
(1)压强从200 kPa增加到500 kPa时,平衡________移动(填“正向”或“逆向”或“不”),理由是________.
(2)压强从500 kPa增加到1000 kPa时,平衡________移动(填“正向”或“逆向”或“不”),其原因可能为________.
查看答案和解析>>
科目: 来源:湖北省荆州中学2012届高三第二次质量检查化学试题 题型:022
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
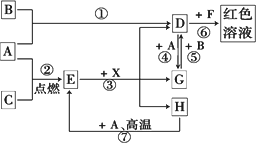
(1)写出化学式:D________、E________
(2)形成单质A的元素在周期表中所处的位置是________.
(3)反应⑥的离子方程式为:________.
(4)反应⑦的化学方程式为________;
(5)写出D的溶液与小苏打溶液反应的离子方程式:________.
查看答案和解析>>
科目: 来源:湖北省荆州中学2012届高三第二次质量检查化学试题 题型:022
在200 mL含Mg2+、Al3+、NH![]() 、H+、Cl-等离子的溶液中,逐滴加入5 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:
、H+、Cl-等离子的溶液中,逐滴加入5 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:
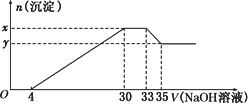
通过计算填写下列空白
(1)x与y的差为( )
(2)原溶液中c(Cl-)=( )
(3)原溶液的pH=( )
(4)原溶液中n(Mg2+)∶n(Al3+)=( )
(5)所加氢氧化钠溶液体积大于33 ml时,反应的离子方程式为________.
查看答案和解析>>
科目: 来源:湖北省荆州中学2012届高三第二次质量检查化学试题 题型:022
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH-
+O2+xOH- Fe3O4+S4O
Fe3O4+S4O![]() +2H2O,回答下列问题.
+2H2O,回答下列问题.
(1)该反应中的还原剂是________.
(2)1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为________.
(3)该反应中,每生成1 mol Fe3O4,该反应转移的电子总的物质的量为________.
(4)Na2S2O3与稀硫酸反应生成一种沉淀和一种有刺激性气味的气体,写出该反应的离子方程式________.
查看答案和解析>>
科目: 来源:浙江省东阳中学高三10月阶段性考试化学试题 题型:022
A、B、C、D、E、F、G、H和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使石蕊试纸变色;②A和I相遇产生白色烟雾;③B和E都能使品红溶液褪色;④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;⑥C和D相遇生成红棕色气体;⑦G在D中燃烧可以产生E和H2O;⑧将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A.回答:
(1)A的化学式是________,②中烟雾的化学式是________;
(2)④中发生反应的化学方程式是________;
(3)⑤中发生反应的化学方程式是________;
(4)C的化学式是________,D的化学式是________;
(5)⑦中发生反应的化学方程式是________;
查看答案和解析>>
科目: 来源:浙江省东阳中学高三10月阶段性考试化学试题 题型:022
现有五种短周期元素
A、B、C、D、E,其原子序数依次增大.A、E同主族,A元素原子半径最小.B元素原子的最外层电子数是内层电子数的2倍.C元素最高价氧化物对应水化物X与其氢化物Y反应生成一种盐.A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.试回答:(1)写出D、E两元素形成的原子个数比为1∶2的化合物的电子式________.
(2)写出Y与氯化铁溶液反应的离子方程式________.
(3)某盐由A、B、D、E四种元素组成,其化学式量为82.该盐水溶液呈________性,其原因是(用离子方程式表示)________.
(4)汽车尾气中含有B、C的氧化物,它们均为有害气体.可在催化剂催化下,利用这两种气体相互反应转化为无害气体.请写出该转化反应的化学方程式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com