
科目: 来源:福建省四地六校2012届高三上学期第三次月考化学试题 题型:022
自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛.含有Fe2O3的钛铁矿(主要成分为FeTiO3,Ti的最高价为+4)制取纳米级TiO2的流程如下:
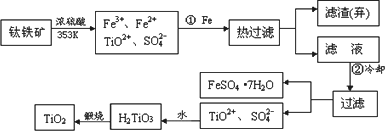
(1)步骤①发生的主要反应是________(用离子方程式表示)
(2)上述制备二氧化钛的过程中,可以利用的副产物是________;考虑成本和废物综合利用因素,废液中应加入________处理.
(3)由金红石制备单质钛,涉及到的步骤为:
TiO2
→TiCl4已知
:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③TiO2(s)+2Cl2(g)![]() TiCl4(s)+O2(g) ΔH=+141.0 kJ·mol-1
TiCl4(s)+O2(g) ΔH=+141.0 kJ·mol-1
则
TiO2(s)+2Cl2(g)+2C(s)反应
TiCl4+2Mg(4)TiO2是白色粉末,不溶于水,也不溶于酸,但能溶于氢氟酸和热的浓硫酸中.请写出TiO2与硫酸反应的方程式________.
查看答案和解析>>
科目: 来源:福建省四地六校2012届高三上学期第三次月考化学试题 题型:022
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.
![]()
(1)写出W的简单离子的原子结构示意图________;氢元素与Z形成原子个数比为1∶1的化合物,其结构式为________.
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示)________;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式________,反应中每转移8 mol电子,消耗的还原剂质量为________g.
(4)写出能说明Y的非金属性比Z弱的一个实验事实:________.
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三第三阶段考试化学试题 题型:022
已知周期表中,元素Q、R、W、Y与元素X相邻.Y的最高化合价氧化物的水化物是强酸.回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料.W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是________;
(2)Q的具有相同化合价且可以相互转变的氧化物是________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)________,其原因是________;
②电子总数相同的氢化物的化学式和立体结构分别是________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料.上述相关反应的化学方程式(各物质用化学式表示)是________.
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三第三阶段考试化学试题 题型:022
某反应中反应物与生成物有
:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.(1)
已知KBrO3在反应中得到电子,则该反应的还原剂是________.(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为________.
(3)根据上述反应可推知________.
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.
还原性:AsH3>X
d.还原性:X>AsH3
(4)写出该反应的化学方程式,并标出电子转移的方向和数目:
查看答案和解析>>
科目: 来源:浙江省富阳场口中学2012届高三11-12月教学质量检测化学试题 题型:022
已知某温度下,KW=1×10-13.A为酸溶液,其pH=a;B为碱溶液,其pH=b.
(1)若A为强酸,B为强碱,且a+b=13,两者等体积混合后,溶液的pH=________;若此时溶液中碱的阳离子浓度大于酸根阴离子浓度,其原因可能是(用文字表述)________.
(2)若A为强酸,B为强碱,二者按体积比为1∶10混合后溶液显中性,则a+b=________.
(3)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为________.
(4)在(3)的混合溶液中,微粒浓度大小关系一定正确的是________(填序号).
①c(MOH)>c(M+)>C(R-)>c(OH-)>c(H+)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
查看答案和解析>>
科目: 来源:浙江省富阳场口中学2012届高三11-12月教学质量检测化学试题 题型:022
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为9.又知B、D、E分别与A、C两元素共同组成的三种化合物X、Y、Z之间能相互发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,1 mol M中含有42 mol电子.回答下列问题:
(1)元素C在周期表中的位置是________;
(2)化合物M中含有的化学键类型有________;
(3)写出化合物Y与Z之间反应的离子方程式________;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则正极上的电极反应式为________.
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第三次考试化学试题 题型:022
(物质结构与性质)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++SO
2CuCl↓+4H++SO![]()
2CuCl2+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
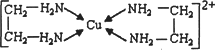
请回答下列问题:
(1)基态Cu原子的核外电子排布式为________.H、N、O三种元素的电负性由大到小的顺序是________.
(2)SO2分子的空间构型为________.与SnCl4互为等电子体的一种离子的化学式为________.
(3)乙二胺分子中氮原子轨道的杂化类型为________.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是________.
(4)②中所形成的配离子中含有的化学键类型有________.(填字母)
a.配位键
b.极性键
c.离子键
d.非极性键
(5)CuCl的晶胞结构如图所示,其中Cl原子的配位数为________.
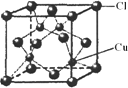
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第三次考试化学试题 题型:022
某学习小组根据化学知识和下表的数据,设计了表中的实验,以验证酸性:盐酸>碳酸>苯酚>碳酸氢根离子,其中不合理的是________.
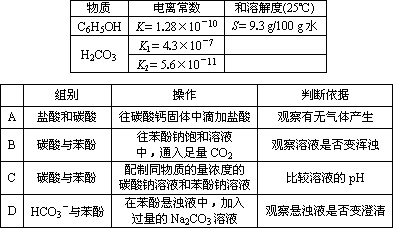
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com