
科目: 来源:浙江省浙江大学附属中学2012届高三上学期期中考试化学试题 题型:022
有一瓶澄清溶液,其中可能含有NH![]() 、K+、Ba2+、Al3+、Fe3+、I-、NO
、K+、Ba2+、Al3+、Fe3+、I-、NO![]() 、CO
、CO![]() 、SO
、SO![]() 、AlO
、AlO![]() .取该溶液进行以下实验:
.取该溶液进行以下实验:
①用PH试纸检验,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液:
a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成.
根据上述实验现象,回答下列问题.
(1)由①可以排除________的存在.
(2)由②可以证明________的存在;同时排除________的存在;理由是________.
(3)由③可以证明________的存在;
写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:
C________;d________.
(4)由④可以排除________的存在,同时证明________的存在.
查看答案和解析>>
科目: 来源:江苏省阜宁高级中学、大丰高级中学、栟茶高级中学2012届高三第二次调研联考化学试题 题型:022
下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式.
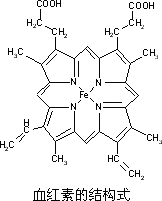
回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是________,写出基态Fe原子的核外电子排布式________.
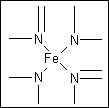
(2)血红素中N原子的杂化方式分别为________、________,在下图的方框内用“→”标出Fe2+的配位键.
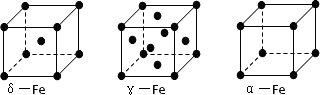
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为________.
查看答案和解析>>
科目: 来源:江苏省阜宁高级中学、大丰高级中学、栟茶高级中学2012届高三第二次调研联考化学试题 题型:022
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表.


回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________mol·L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol·L-1,c(AsO![]() )的最大是________mol·L-1.
)的最大是________mol·L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式________.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为________;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为________.
查看答案和解析>>
科目: 来源:江苏省阜宁高级中学、大丰高级中学、栟茶高级中学2012届高三第二次调研联考化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省阜宁高级中学、大丰高级中学、栟茶高级中学2012届高三第二次调研联考化学试题 题型:022
我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染.赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质.
(1)一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式________.
(2)为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:
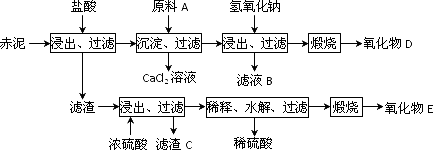
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解).
①氧化物D的化学式是________,原料A最好是下列物质中的________.
A.氨水
B.氢氧化钠
C.生石灰
D.双氧水
②写出上述工艺中投入氢氧化钠时反应的离子方程式:________.
③写出上述工艺中稀释时发生水解反应的化学方程式:________.
查看答案和解析>>
科目: 来源:江苏省阜宁高级中学、大丰高级中学、栟茶高级中学2012届高三第二次调研联考化学试题 题型:022
下表所列各组物质中,不能通过一步反应实现如图所示转化的是________
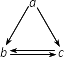
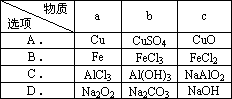
查看答案和解析>>
科目: 来源:江苏省梅村高级中学2012届高三11月练习化学试题 题型:022
现有部分前四周期元素的性质或原子结构如下表:
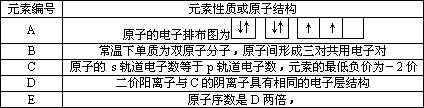
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为________;
(2)B的氢化物的分子空间构型是________,该氢化物的等电子体是________;
(3)E的价电子排布式是________,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为________;
(4)AC2在高温高压下所形成的晶胞如图所示.该晶体的类型属于________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为________;
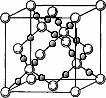
(5)D的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________.
查看答案和解析>>
科目: 来源:江苏省梅村高级中学2012届高三11月练习化学试题 题型:022
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~900℃时,硫铁矿在纯净的氧气中煅烧,可能发生下列反应:
①3FeS2+8O2→Fe3O4+6SO2
②4FeS2+11O2→2Fe2O3+8SO2
(1)为使FeS2煅烧完全生成Fe2O3,使用过量氧气,当氧气过量20%时,求所得炉气中SO2的体积分数.(写出计算过程)
(2)480 g纯净的FeS2在氧气中完全反应,若所得固体中,Fe和O的物质的量之比n(Fe)∶n(O)=4∶a,此时消耗氧气b mol.
①试写出b与a的关系式:________.
②b的最大值为________,最小值为________.
查看答案和解析>>
科目: 来源:江苏省梅村高级中学2012届高三11月练习化学试题 题型:022
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
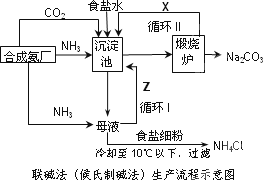
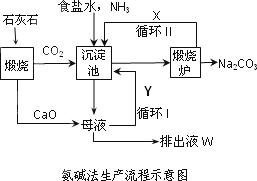
(1)沉淀池中发生反应的化学方程式为________;
(2)X是________,Y是________(填化学式);
(3)从理论上分析,在氨碱法生产过程中________(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为________;
(4)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是________;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,
促进碳酸氢钠结晶析出
(5)相比于氨碱法,指出联碱法的一项优点________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com