
科目: 来源:吉林省白山二中2012届高三第二次月考化学试题 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:吉林省白山二中2012届高三第二次月考化学试题 题型:022
将40 g NaOH溶于水,配成250 mL溶液甲,甲的浓度为________mol/L
(将正确选项的标号填入空格,下同).将50 mL甲加水稀释至100 mL后,得溶液乙,乙的浓度为________mol/L.将10 mL乙溶液与质量分数为9%、密度为1.11 g/cm3的NaOH溶液10 mL混合,该混合溶液丙的浓度为________mol/L(忽略溶液体积变化).混合溶液丙能与________mL 0.5 mol/L的盐酸恰好完全中和.

查看答案和解析>>
科目: 来源:四川省成都石室中学2012届高三上学期期中考试理综化学试题 题型:022
如图所示:化学电源的原理为:
Fe+NiO2+2H2O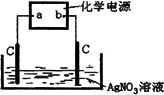
(1)
写出电解池中电解时发生的离子方程式:________.(2)
电源a极上发生的电极方程式________.(3)
电解一段时间后,化学电源的电能被消耗,若要对其进行充电,电源负极应连接________(填“a”或“b”),该电极的方程式为________.(4)
若电解液的体积为200 mL(不考虑电解过程中体积变化),则电解后溶液的pH为________.查看答案和解析>>
科目: 来源:甘肃省张掖中学2012届高三第二次月考化学试题 题型:022
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同).
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)其他条件不变,升高温度其平衡________移动,减小压强其平衡________移动.
(3)达到平衡后,改变某一外界条件(不改变H2、CO的量),反应速率v与时间t的关系如下图.图中t4时引起平衡移动的条件可能是________;图中表示平衡混合物中CO的含量最高的一段时间是________.
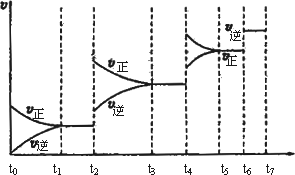
查看答案和解析>>
科目: 来源:甘肃省张掖中学2012届高三第二次月考化学试题 题型:022
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是________,且各离子的物质的量之比为________;肯定不含的阳离子是________,判断的理由是________.
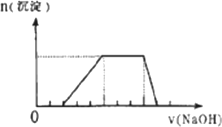
查看答案和解析>>
科目: 来源:甘肃省张掖中学2012届高三第二次月考化学试题 题型:022
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
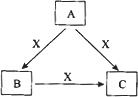
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为________.
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为________.
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构.
①B的电子式为________.
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为________.
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
①A中所含有的化学键是________.
②将4.48 L(标准状况下)X通入100 mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为________.
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100 mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为________.
查看答案和解析>>
科目: 来源:浙江省浙江大学附属中学2012届高三上学期期中考试化学试题 题型:022
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布为msnmpn;③R原子核外L层电子数为奇数;④Q、X原子P轨道的电子数分别为2和4.请回答下列问题:
(1)Z2+的核外电子排布式是________.
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键.
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________.
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答).
(5)Q的一种氢化物相对分子质量为26,其分子中
σ键与π的键数之比为________.(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于________(填晶体类型).
查看答案和解析>>
科目: 来源:浙江省浙江大学附属中学2012届高三上学期期中考试化学试题 题型:022
近年来,我国许多地区气候异常现象频发,如:云南持续几个月的干旱、北方频发的沙尘暴等,使环境问题再次成为公众的焦点SO2、NOx、CO2是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
(1)下列做法中,有利于降低大气中的SO2、NOx、CO2浓度的有________(选填字母).
a.直接用煤做燃料
b.开私家车
c.植树造林以增加绿化面积
d.研究、开发太阳能使之走进寻常百姓家
(2)用CO和H2做原料可以合成甲醇,作为液体燃料.已知:
①2H2(g)+CO(g)+3/2O2(g)![]() CO2(g)+2H2O(g);ΔH=-594.1 kJ/mol
CO2(g)+2H2O(g);ΔH=-594.1 kJ/mol
②2CH3OH(1)+3O2(g)![]() 2CO2(g)+4H2O(g);ΔH=-1452 kJ/mol
2CO2(g)+4H2O(g);ΔH=-1452 kJ/mol
请写出用合成气(CO和H2)合成1 mol液态甲醇的热化学反应方程式:________
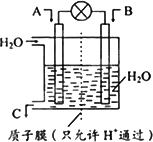
(3)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为________极
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:________
查看答案和解析>>
科目: 来源:浙江省浙江大学附属中学2012届高三上学期期中考试化学试题 题型:022
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多1,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀,各物质间的转化关系如图所示(反应条件多数已略去):
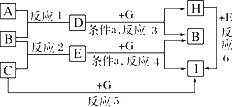
请回答:
(1)在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是________.
(2)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是________.
(3)反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式________.
(4)反应⑥的离子方程式是________.
(5)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com