
科目: 来源:山东省济宁市鱼台二中2012届高三11月月考化学试题 题型:022
纯净物A、B、C、D、E均是中学常见的物质.其转化关系如下图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体
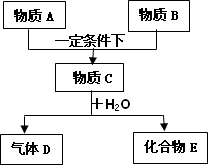
请回答下列问题:
(1)若A、B、D均为短周期元素的单质,C为化合物且气体D就是物质B,又知D气体不可燃,则B的分子式是________,化合物E的化学式为________.
(2)若A、C、D均为短周期元素的单质,B、E为氧化物,且化合物E通常状况下为气体,在一定条件下E还可以和氧气发生反应.则A位于在周期表中的________周期________族.A和B反应生成C的化学方程式是________.
查看答案和解析>>
科目: 来源:山东省济宁市鱼台二中2012届高三11月月考化学试题 题型:022
工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g-0.5g.已知NaNO2能发生如下反应:aNO![]() +xI-+yH+=bNO↑+cI2+zH2O,
+xI-+yH+=bNO↑+cI2+zH2O,
请回答下列问题:
(1)上述反应中,x、y、z的数值分别是________(全对才给分).
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为________.
(3)某工厂废切削液中含有2%-5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污的N2,该物质是________,
a.NaCl
b.H2O2
c.NH4Cl
d.浓H2SO4
所发生反应的离子方程式为:________.
查看答案和解析>>
科目: 来源:云南省昆明八中2012届高三上学期期中考试化学试题 题型:022
钛(Ti)被称为继铁、铝之后的第三金属,我国西南地区的钒钛磁铁矿储量十分丰富.如下图所示,将钛厂、甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.
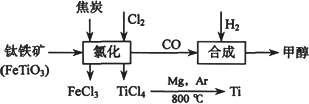
请填写下列空白:
(1)已知:①Mg(s)+Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(s)![]() 2MgCl2(s)+Ti(s);ΔH________.
2MgCl2(s)+Ti(s);ΔH________.
(2)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是________.
(3)写出钛铁矿在高温下经氯化法得到四氯化钛的化学方程式:________.
查看答案和解析>>
科目: 来源:云南省昆明八中2012届高三上学期期中考试化学试题 题型:022
下图表示各物质之间的转化关系.已知:常温下D、E、F、I、J为气体,其中E为黄绿色气体;H、I、J都为氧化物;B是一种常见的无色液体;M为红褐色固体.
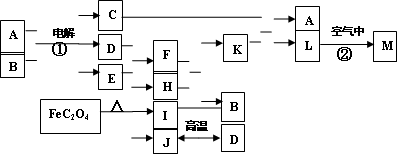
(1)反应①是重要的化学工业反应原理,写出其反应的离子方程式________;
(2)写出反应②的化学方程式________.
(3)反应中FeC2O4生成H、I、J三种物质的物质的量相等,则J的电子式为________;
查看答案和解析>>
科目: 来源:山西省汾阳中学2011届高三第二次月考化学试题 题型:022
2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1.请回答问题:
2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1.请回答问题:
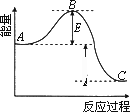
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________.该反应通常用V2O3作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________.
(2)图中ΔH________kJ·mol-1.
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式________.
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=________mol·L-1·min-1、v(SO3)________mol·L-1·min-1.
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH________.
查看答案和解析>>
科目: 来源:山东省潍坊三县2011届高三阶段性教学质量检测化学试题 题型:022
(1)
一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)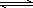 2N2O5(g);若已知K350℃<K300℃,则该反应是________反应(填“吸热”或“放热”).反应达平衡后,若再通入一定量NO2,则平衡常数K将________,NO2的转化率________(填“增大”、“减小”或“不变”)
2N2O5(g);若已知K350℃<K300℃,则该反应是________反应(填“吸热”或“放热”).反应达平衡后,若再通入一定量NO2,则平衡常数K将________,NO2的转化率________(填“增大”、“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
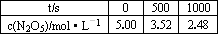
①写出该反应的平衡常数表达式:K=________.
②1000 s内N2O5的分解速率为________.
③若每有1 mol N2O5分解,放出或吸收QkJ的热量,写出该分解反应的热化学方程式________.
查看答案和解析>>
科目: 来源:山东省潍坊三县2011届高三阶段性教学质量检测化学试题 题型:022
A、B、C、D和甲有以下转化关系.已知物质甲是短周期元素组成的盐,且是某种消毒液的有效成分,沉淀D可溶于酸.
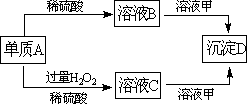
请回答下列问题:
(1)组成A的元素在周期表中位于第________周期第________族.
(2)鉴定C中阳离子(不考虑H+)的操作和现象是________.
(3)A转化为B时会放出无色气体E,在298K时1 mol A完全反应放出热量QkJ,则该反应的热化学方程式为________.
(4)若A转化为C时无气体放出,写出该反应的化学方程式:________.
(5)写出溶液C和溶液甲反应的离子方程式:________.
查看答案和解析>>
科目: 来源:山东省泰安市2011届高三上学期期末考试化学试题 题型:022
臭氧(O3)能与KI溶液反应,生成O2等.在反应后的溶液中滴入酚酞变为红色,若滴入淀粉则变为蓝色.为测定某环境空气中的臭氧含量,将0℃、1.01×105 Pa的空气33.6 m3通过KI溶液,使之完全反应,所得溶液用0.0100 mol·L-1的Na2S2O3溶液60.0 mL恰好滴定达终点.反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI.
(1)臭氧通入KI溶液中的化学方程式:________;
(2)滴定过程中选择的指示剂是________,达到滴定终点时的现象为________;
(3)计算该空气中臭氧的体积分数.
查看答案和解析>>
科目: 来源:山东省泰安市2011届高三上学期期末考试化学试题 题型:022
已知反应:3I-(aq)+S2O![]() (aq)
(aq)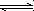 I
I![]() (aq)+2SO
(aq)+2SO![]() (aq)
(aq)
(1)写出反应的平衡常数表达式K=________;
(2)下图表示反应过程中有关物质的能量,则反应的ΔH________0(填“>”、“<”或“=”);
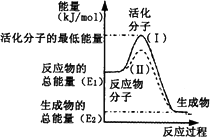
(Ⅰ)、(Ⅱ)两线中,使用催化剂的是________线;
(3)反应中发生反应的I-与被氧化的I-的物质的量比为________;
(4)反应的速率可以用I![]() 与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,记录的数据如下:
与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,记录的数据如下:
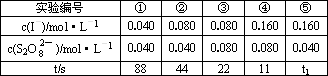
则:该实验的目的是________,显色时间t1=________分析表中数据,得出的结论是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com