
科目: 来源:江西省南昌一中2012届高三11月月考化学试题(人教版) 题型:022
已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X________、Z________.
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的结构式为:________,它的共价键属于________(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为________.
(3)由X、Y、Z所形成的常见离子化合物是________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:________;
X与W形成的化合物与水反应时,水是________(填:氧化剂、还原剂).
查看答案和解析>>
科目: 来源:江西省南昌一中2012届高三11月月考化学试题(人教版) 题型:022
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀.(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F________,G________.
(2)将混合物中两种金属分离开的最简单的方法是
(3)D→E的转化中,加入过量的X可能是________.
A.饱和NaCl溶液
B.NaOH溶液
C.氨水
D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:________;
H→I:________.
查看答案和解析>>
科目: 来源:江西省南昌一中2012届高三11月月考化学试题(人教版) 题型:022
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称)________,以下三种说法中,可以验证该结论的是(填写编号)________;
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2 LO2,消耗该化合物的质量为________.
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为________.
查看答案和解析>>
科目: 来源:江苏省泰州中学2012届高三上学期期中考试化学试题(人教版) 题型:022
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图:
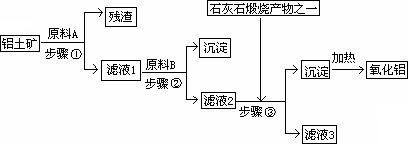
(1)原料A的名称是________,步骤①反应的离子方程式是________.
(2)滤液1中要加入稍过量原料B,原料B的化学式是________,步骤②反应的离子方程式是________.
(3)步骤③的化学方程式是:________.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响________.
查看答案和解析>>
科目: 来源:山东省潍坊市四县一校2012届高三上学期模块监测考试化学试题(人教版) 人教版 题型:022
过氧化氢俗名双氧水,医疗上利甩它有杀菌消毒作用来清洗伤口.根据下列反应回答问题.
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2![]() 2Ag+O2↑+H2O
2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH![]() 2K2CrO4+3K2SO4+8H2O
2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是________(填代号,下同),H2O2既体现氧化性又体现还原性的反应是________.
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是________.
(3)某强酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO![]() 、H2O、Mn2+、H2O2、H+已知该反应中H2O2只发生了如下过程:H2O2→O2.
、H2O、Mn2+、H2O2、H+已知该反应中H2O2只发生了如下过程:H2O2→O2.
①反应体系选择的酸是________(填"序号").
A.盐酸
B.浓硫酸
C.稀硫酸
D.醋酸
②如果上述反应中有6.72 L(标准状况)气体生成,转移的电子为________mol.
(4)H2O2有时可作为矿业废液消毒剂,有"绿色氧化剂"的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O+H2O=A+NH3(化学方程式已配平),试指出生成物A的化学式为________,并阐明H2O2被称为绿色氧化剂的理由是________.
查看答案和解析>>
科目: 来源:安徽省淮北一中2012届高三第三次月考化学试题(人教版) 题型:022
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,该反应的化学方程式为________.
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收.
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO![]() =2H3AsO4+3S+10NO2↑+2H2O,若生成2 mol H3AsO4,则反应中转移电子的物质的量为________.若将该反应设计成一原电池,则NO2应该在________极附近逸出.
=2H3AsO4+3S+10NO2↑+2H2O,若生成2 mol H3AsO4,则反应中转移电子的物质的量为________.若将该反应设计成一原电池,则NO2应该在________极附近逸出.
(4)将(3)中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为________(设该条件下的气体摩尔体积为23.8 L·mol-1,结果保留到小数点后三位).
查看答案和解析>>
科目: 来源:安徽省淮北一中2012届高三第三次月考化学试题(人教版) 题型:022
下图所示物质中,只有X是单质,常温下A和B呈气态,且B是导致酸雨的大气污染物,D是淡黄色固体.

据此回答下列问题:
(1)物质D的电子式为________,其阴阳离子个数比为________.
(2)请列举物质F的两种用途:________、________.
(3)写出X和Y反应的化学方程式________;A与D反应时若生成21.2 g的C,则反应中转移电子数目为________.
(4)请写出Y和F反应的离子方程式________.
查看答案和解析>>
科目: 来源:安徽省淮北一中2012届高三第三次月考化学试题(人教版) 题型:022
A、B、C、D、E、F、G是元素周期表中1~36号的七种常见元素,其原子序数依次增大.其中B、D、G三种元素的原子核外未成对电子数均等于其周期序数;F的单质常用于工业上制漂白粉;D与A、E均可形成原子个数比为1:1和1:2的化合物.
请回答下列问题:
(1)F在元素周期表中的位置________,B、C、D、E元素第一电离能由大到小的顺序是________(用元素符号表示);
(2)F、G两元素的单质间反应所得产物为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醇,丙酮等有机溶剂.据此判断该产物晶体为________晶体;该产物中G元素相应价态离子的核外电子排布式为________;
(3)B、C、D均可与A形成10电子和18电子的分子.
①在B、C、D分别与A形成的10电子分子中,极性最强的共价键是________(用化学键表示).A、B、C三元素形成的最简单分子中σ键与π键个数比为________;
②C、D分别与A形成的18电子分子X、Y可用作火箭推进剂.已知16 g液态X与足量液态Y充分反应生成一种液态化合物和一种气态单质,并放出838 kJ的热量,试写出X与Y反应的热化学方程式________.
查看答案和解析>>
科目: 来源:福建省四地六校2012届高三期中联考试题化学试题 题型:022
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca.
(1)Ca的原子结构示意图________.
(2)配平用钙线氧脱鳞的化学方程式:
________P+________FeO+________CaO![]() ________Ca3(PO4)2+________Fe
________Ca3(PO4)2+________Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为________,检测Mn+的方法是________(用离子方程式表达).
(4)取1.6 g钙线试样,与水充分反应,生成224 ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3________g.
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S.
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-2
S(s)+O2(g)=YO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com