
科目: 来源:福建省师大附中2012届高三上学期期中考试化学试题(人教版) 人教版 题型:022
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去).请填空:
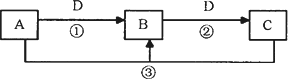
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是________;工业上制取A的离子方程式为________.
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________.
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是________.
(4)若D空气质量预报必报的气体,A、B、C的的焰色反应都呈黄色,则可以证明B是否变质的一组试剂是________(请写出试剂名称).
查看答案和解析>>
科目: 来源:河北省衡水中学2012届高三第三次调研考试化学试题(人教版) 人教版 题型:022
黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1.黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4-,其中CN-的电子式为![]() .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?________(填“是”或“不是”).
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过400℃时会分解,试配平该反应的化学方程式:
□K4Fe(CN)6![]() □KCN+□Fe3C+□C+□N2↑
□KCN+□Fe3C+□C+□N2↑
(3)黄血盐可与高锰酸钾溶液反应,其化学方程式为K4Fe(CN)6+KMnO4+H2SO4→KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有________(填化学式).
②若有1 mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为________mol.
查看答案和解析>>
科目: 来源:河北省衡水中学2012届高三第三次调研考试化学试题(人教版) 人教版 题型:022
水是生命之源,也是化学反应中的主角.请回答下列问题:(下列问题所涉及的答案可能有多种,只需答出一种情况即可)
Ⅰ.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离的方程式为________.
Ⅱ.有以下五组离子
①K+、Cl-、NO3-、S2-;
②K+、Fe2+、I-、SO42-;
③Na+、Cl-、NO3-、SO42-;
④Na+、Ca2+、Cl-、HCO3-;
⑤K+、Ba2+、Cl-、NO3-.在由水电离产生的c(OH-)=1×10-13 mol/L溶液中,一定不能大量共存的离子组是________(填序号)
Ⅲ.在许多反应中H2O扮演不同的“角色”.请结合所学完成下列反应
(1)H2O参与的置换反应:
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质,W、V是化合物
①W是水,离子方程式为________;
②V是水,化学方程式为________.
(2)水既不是氧化剂也不是还原剂的氧化还原反应:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A+H2O________;
②B+H2O________;
查看答案和解析>>
科目: 来源:江苏省南通市通州区2012届高三重点热点专项检测化学试题 题型:022
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.
回答下列问题:
(1)写出基态Fe2+的核外电子排布式________.K4[Fe(CN)6]中Fe2+与CN-之间的作用力是________.
(2)CN-中碳原子的杂化方式为________;1 mol CN-中含有π键的数目为________.
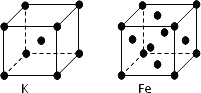
(3)金属钾、铁的晶体的晶胞结构如下图,钾、铁两种晶体晶胞中金属原子的配位数之比为________.
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为________.
查看答案和解析>>
科目: 来源:江苏省南通市通州区2012届高三重点热点专项检测化学试题 题型:022
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下:
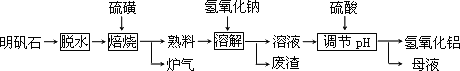
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,其中氧化剂为________.
2Al2O3+9SO2,其中氧化剂为________.
(2)“溶解”时反应的离子方程式为________.
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是________.
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L的H2SO4,配制1 L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8 g/cm3)________mL
(5)“废渣”、“母液”中可回收的物质分别是________.
查看答案和解析>>
科目: 来源:山东省潍坊市2012届高三一轮模拟考试化学试题 题型:022
现有A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大.已知A与D,C与F分别同主族,D、E、F、G同周期;A分别与B、C可形成含有10个电子的共价化合物分子,B的最外层电子数是其次外层电子数的2倍,且A、B的最外层电子数之和比C的最外层电子数少1;E位于B的前一主族.
请回答下列问题:
(1)元素G在周期表中的位置________,F的原子结构示意图________.
(2)A、C、D三种元素组成一种常见化合物,该化合物所含的化学键类型为________,工业上利用某一个反应可同时生产该化合物和单质G,写出该反应的离子方程式________;
(3)D、E元素的最高价氧化物所对应的水化物之间反应的离子方程式________.
(4)含有E阳离子的盐常用作净水剂,其原因为________.(用离子方程式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com