
科目: 来源:天津市青光中学2011届高三上学期期中考试化学试题 题型:022
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)
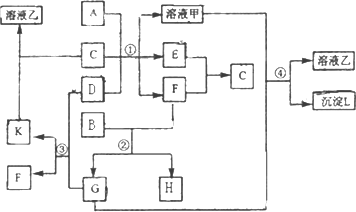
(1)A、B、C、D代表的物质分别为________、________、________、________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、________(填化学式);
(4)反应③产物中K的化学式为________;
(5)反应④的离子方程式为________.
查看答案和解析>>
科目: 来源:天津市青光中学2011届高三上学期期中考试化学试题 题型:022
A、B、C、D、E五种物质能按图示变化(反应条件略):
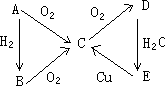
①若A在通常状况下是固体,则A、B、C、D、E的化学式分别为:A________,B________,C________,D________,E________.
②若A在通常状况下是气体,则A、B、C、D、E的化学式分别是:A________,B________,C________,D________,E________.
查看答案和解析>>
科目: 来源:江苏省南京市金陵中学2011届高三第四次模拟考试化学试题 题型:022
海底热液研究(图1)处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Ni2+的核外电子排布式是_________.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是________.


(3)下列说法正确的是_________.
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)“酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为_________.
(5)FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是_________.在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为_________.
查看答案和解析>>
科目: 来源:江苏省南京市金陵中学2011届高三第四次模拟考试化学试题 题型:022
由黄铜矿为原料(主要成分为CuFeS2)制备99.95%~99.98%精铜的流程如下:
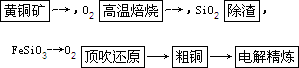
(1)高温焙烧第一反应为2CuFeS2+4O2![]() Cu2S+2FeO+3SO2,该反应中氧化剂为_________.产物Cu2S在1 200℃高温下继续反应:2Cu2S+3O2
Cu2S+2FeO+3SO2,该反应中氧化剂为_________.产物Cu2S在1 200℃高温下继续反应:2Cu2S+3O2![]() 2Cu2O+2SO2,2Cu2O+Cu2S
2Cu2O+2SO2,2Cu2O+Cu2S![]() 6Cu+SO2.6 mol CuFeS2和14.25 mol O2反应,理论上可得到Cu_________mol(假定各步反应都完全).
6Cu+SO2.6 mol CuFeS2和14.25 mol O2反应,理论上可得到Cu_________mol(假定各步反应都完全).
(2)取三份质量均为16.9 g的上述粗铜,成分为Cu、Fe、Zn.现在需要分析其中铜的含量,进行如下实验(所有气体体积均为标况下的数据):
①取一份粗铜放入足量稀硫酸中,共放出氢气1.568 L.
②另取一份粗铜放入稍过量的较浓硝酸中,加热使合金铜完全溶解,收集到了NO和NO2的混合气体8.736 L,与3.304 L O2混合后,得到的混合气体恰好被水完全吸收.
③再取一份粗铜进行电解精炼,阳极完全溶解后阴极增加质量17.28 g.
求粗铜中Cu的质量分数(保留一位小数).
查看答案和解析>>
科目: 来源:江苏省南京市金陵中学2011届高三第四次模拟考试化学试题 题型:022
拉氧头孢钠是一种抗生素,合成拉氧头孢钠的中间体G的路线如下:
A(CH2CN)![]() B
B![]() C(NCCH2NH2·H2SO4)
C(NCCH2NH2·H2SO4)
![]() D(HOCH2CN)
D(HOCH2CN)![]() E(HOCH2COOH)
E(HOCH2COOH)
![]() F(HOCH2COOCH3)
F(HOCH2COOCH3)![]() G(C16H16O4)
G(C16H16O4)
(1)B的结构简式为_________.
(2)E→F的反应类型为_________.
(3)酚的苯环上某些氢原子比较活泼.由E合成F时还可能生成一种相对分子持量为194的副产物H,H的结构简式为_________.
(4)M是E的同分异构体,M具有以下特征:①苯环上只有2个取代基;②遇氯化铁显色,但与小苏打不反应;③1 mol M最多能与2 mol NaOH溶液反应.则M的结构有_________种.
(5)G含有酯基,请写出F→G的化学反应方程式:________.
(6)写出由化合物E制备化合物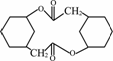 的合成路线流程图(无机试剂任选).合成路线流程图示例:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例:CH3CH2OH![]() H2CCH2
H2CCH2![]() H2CBrCH2Br
H2CBrCH2Br
查看答案和解析>>
科目: 来源:江苏省南京市金陵中学2011届高三第四次模拟考试化学试题 题型:022
现代炼锌的方法可分为火法(蒸馏法)和湿法(电解法)两大类.
Ⅰ.火法炼锌工艺如下:
焙烧和蒸馏过程中发生的主要反应有:
2ZnS(s)+3O2(g)![]() 2ZnO(s)+2SO2(g) ΔH1=a kJ-·mol-1 ①
2ZnO(s)+2SO2(g) ΔH1=a kJ-·mol-1 ①
2C(s)+O2(g)![]() 2CO(g) ΔH2=b kJ·mol-1 ②
2CO(g) ΔH2=b kJ·mol-1 ②
ZnO(s)+CO(g)![]() Zn(g)+CO2(g) ΔH3=c kJ·mol-1 ③
Zn(g)+CO2(g) ΔH3=c kJ·mol-1 ③
(1)以上三个反应中,一定是放热反应的是_________(填序号).
(2)反应:ZnS(s)+C(s)+2O2(g)![]() Zn(g)+SO2(g)+CO2(g) ΔH=_________kJ·mol-1.
Zn(g)+SO2(g)+CO2(g) ΔH=_________kJ·mol-1.
Ⅱ.湿法炼锌工艺如下:
(3)写出“浸出”主要反应的离子方程式:_________.
(4)“电解”获得锌的电极反应为_________.
(5)该工艺中可循环利用的物质是_________(填化学式).
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试海南卷化学 题型:022
纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:________;
(2)写出“联合制碱法”有关反应的化学方程式:________;________;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________;
(4)绿色化学的重要原则之一是提高反应的原子利用率.根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=________.
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试海南卷化学 题型:022
根据图示回答下列问题:
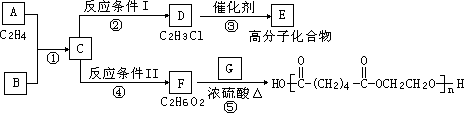
(1)写出A、E、G的结构简式:A________,E________,G________;
(2)反应②的化学方程式(包括反应条件)是________,反应④化学方程式(包括反应条件)是________;
(3)写出①、⑤的反应类型:①________、⑤________.
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试海南卷化学 题型:022
下表为元素周期表的一部分,请回答有关问题:
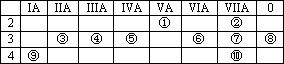
(1)⑤和⑧的元素符号是________和________;
(2)表中最活泼的金属是________,非金属最强的元素是________;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:________,________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com