
科目: 来源:山东省汶上一中2012届高三10月月考化学试题 题型:022
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)选择性催化还原法的脱硝原理为:
6NOx+4x NH3![]() (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3 mol电子,生成标准状况下N2的体积为_________L.
②已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5 kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=_________.
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
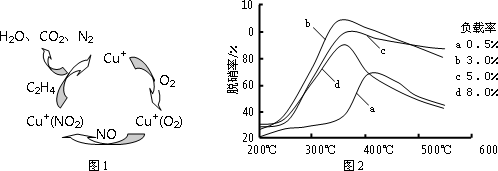
①写出该脱硝原理总反应的化学方程式:_________.
②为达到最佳脱硝效果,应采取的条件是_________.
查看答案和解析>>
科目: 来源:山东省诸城市2012届高三10月月考化学试题 题型:022
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.
(1)现有以下5种物质:SO2、SiO2、CaO、Fe2O3、Na2O2、Al2O3.按照不同的分类标准,它们中有一种物质与其它物质有明显的不同,请找出这种物质并写出依据(试写出任意一种合理的分类方法):________.
(2)从上述物质中分别找出两种能相互反应的物质,试写出符合下列条件的方程式各一个:
①属于氧化还原反应________,
②属于非氧化还原反应________.
查看答案和解析>>
科目: 来源:内蒙古包头三十三中2012届高三上学期期中考试化学试题 题型:022
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-![]() 2H++O2↑
2H++O2↑
还原反应:MnO4-+5e-+8H+![]() Mn2++4H2O
Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:________.
(2)若有0.5 mol H2O2参加此反应,电子转移的物质的量为________;若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:________;这时若有1 mol H2O2发生分解,电子转移个数为________.
查看答案和解析>>
科目: 来源:内蒙古包头三十三中2012届高三上学期期中考试化学试题 题型:022
化学反应经常伴随着颜色变化,下列有关反应显示的颜色正确的有________.
①氢氧化亚铁在空气中最终变为灰绿色;
②淀粉溶液遇碘化钾变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色;
④品红溶液通入过量氯气后褪色;
⑤无水硫酸铜吸收水蒸气变成浅绿色;
⑥新制氯水久置后变为无色;
查看答案和解析>>
科目: 来源:内蒙古包头三十三中2012届高三上学期期中考试化学试题 题型:022
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-![]() 2H++O2↑
2H++O2↑
还原反应:MnO4-+5e-+8H+![]() Mn2++4H2O
Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:________.
(2)若有0.5 mol H2O2参加此反应,电子转移的物质的量为________;若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:________;这时若有1 mol H2O2发生分解,电子转移个数为________.
查看答案和解析>>
科目: 来源:内蒙古包头三十三中2012届高三上学期期中考试化学试题 题型:022
化学反应经常伴随着颜色变化,下列有关反应显示的颜色正确的有________.
①氢氧化亚铁在空气中最终变为灰绿色;
②淀粉溶液遇碘化钾变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色;
④品红溶液通入过量氯气后褪色;
⑤无水硫酸铜吸收水蒸气变成浅绿色;
⑥新制氯水久置后变为无色;
查看答案和解析>>
科目: 来源:辽宁省抚顺二中2012届高三第一次月考化学试题 题型:022
[选修3:物质结构与性质]
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
(1)E元素基态原子的电子排布式为________.
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________(填元素符号)
(3)D元素与氟元素相比,电负性:D________F(填“>”、“=”或“<”).
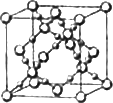
(4)BD2在高温高压下所形成的晶体其晶胞如图所示.该晶体的类型属于________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为________.1 mol B2A2分子中含σ键的数目是________.
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]-生成,则[E(OH)4]-中存在________.
a.共价键
b.配位键
c.σ键
d.π键
查看答案和解析>>
科目: 来源:安徽省泗县双语中学2012届高三摸底考试化学试题 题型:022
Ⅰ、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是________.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2![]() 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10![]() P4+10CO
P4+10CO
每生成1 mol P4时,就有________mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2![]() C6H6O6+2H++2I- 2S2O32-+I2
C6H6O6+2H++2I- 2S2O32-+I2![]() S4O62-+2I-
S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL.该溶液中维生素C的物质的量是________mol.
Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(4)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是________.
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
□Ce3++□H2O2+□H2O![]() □Ce(OH)4↓+□________.
□Ce(OH)4↓+□________.
查看答案和解析>>
科目: 来源:天津市青光中学2011届高三上学期期中考试化学试题 题型:022
X﹑Y﹑Z﹑W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y﹑W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
(1)Y的元素符号是________.
(2)XW的化学式是________.
(3)XW与YX3反应生成一种盐,该盐水溶液的pH________7(填“大于”﹑“小于”或“等于”),其原因是(用离子方程式表示)________.
(4)Z元素氢化物的沸点比H2O________(填“低”或“高”).Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com