
科目: 来源:江苏省梅村高级中学2012届高三1月双周练化学试题 题型:022
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图.试回答下列问题
(1)下列说法正确的是________(选填序号).
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷和镓都属于p区元素
E.半导体GaP、SiC与砷化镓为等电子体
(2)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到, 该反应在700℃进行,反应的方程式为:________.
AsH3空间形状为:________(CH3)3Ga中镓原子杂化方式为:________.
(3)Ga的核外价电子排布式为:________.
(4)AsH3沸点比NH3低,其原因是:________.
查看答案和解析>>
科目: 来源:2013年普通高等学校招生全国统一考试天津卷理综化学 题型:022
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3O2![]() Al2O3+3H2
Al2O3+3H2
电解过程中,以下判断正确的是________.

查看答案和解析>>
科目: 来源:2013年普通高等学校招生全国统一考试安徽卷理综化学 题型:022
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O![]() 转化为Cr3+.某课题组研究发现,少量铁明矾Al2Fe(SO4)4·24H2O即可对该反应堆起催化作用.
转化为Cr3+.某课题组研究发现,少量铁明矾Al2Fe(SO4)4·24H2O即可对该反应堆起催化作用.
为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
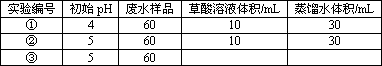
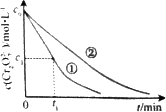
测得实验①和②溶液中的Cr2O![]() 浓度随时间变化关系如图所示.
浓度随时间变化关系如图所示.
(2)上述反应后草酸被氧化为________(填化学式).
(3)实验①和②的结果表明________;实验①中o~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示).
(4)该课题组队铁明矾Al2Fe(SO4)4·24H2O中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:________;
假设三:________;
…………
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2Fe(SO4)4·24H2O、Al2(SO4)3等.溶液中Cr2O![]() 的浓度可用仪器测定)
的浓度可用仪器测定)
![]()
查看答案和解析>>
科目: 来源:2013年普通高等学校招生全国统一考试安徽卷理综化学 题型:022
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:

(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”).
(2)Z的第一电离能比W的________(填“大”或“小”);XY2油固态变为气态所需克服的微粒间作用力是________;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称________.
(3)震荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是________.
(4)在25°、101 kpa下,已知13.5 g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是________.
查看答案和解析>>
科目: 来源:2013年普通高等学校招生全国统一考试安徽卷理综化学 题型:022
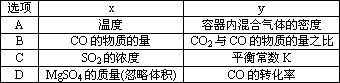
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO3( s)+CO(g)![]() MgO( s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO( s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

查看答案和解析>>
科目: 来源:2013年普通高等学校招生统一考试(江苏卷)化学试题 题型:022
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:

(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取.①分离出甲醇的操作是的________.
②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是________.
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母).
a.蒸馏除去乙醚
b.重结晶
c.过滤除去干燥剂
d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________,再________.
查看答案和解析>>
科目: 来源:2013年普通高等学校招生统一考试(江苏卷)化学试题 题型:022
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
(1)X与Y所形成化合物晶体的晶胞如下图所示.
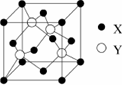
①在1个晶胞中,X离子的数目为________.
②该化合物的化学式为________.
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是________.
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________.
(4)Y与Z可形成YZ2-
①YZ2-的空间构型为________(用文字描述).
②写出一种与YZ42-互为等电子体的分子的化学式:________.
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________.
查看答案和解析>>
科目: 来源:2013年普通高等学校招生统一考试(江苏卷)化学试题 题型:022
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域.某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2.3350 g样品,配制成100.00 mL溶液A;②准确量取25.00 mL溶液A,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液31.25 mL;③另取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况).
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”、或“偏低”或“不变”).
(2)氨气常用________检验,现象是________.
(3)通过计算确定银硫酸镍铵的化学式________(写出计算过程).
查看答案和解析>>
科目: 来源:陕西省渭南市下吉中学2012届高三第二次质量检测化学试题 题型:022
在通常状况下,A为固态单质.根据下图转化关系,回答:
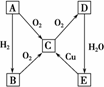
(1)写出A、C、E的化学式:A________,C________,E________.
(2)写出下列反应的化学方程式:
①E→C:________;
②C→D:________.
(3)B与E的浓溶液________发生反应(填“能”或“不能”),若能反应,则反应的化学方程式为________,反应现象________.
查看答案和解析>>
科目: 来源:陕西省渭南市下吉中学2012届高三第二次质量检测化学试题 题型:022
有一透明溶液,可能含有Al3+、Fe3+、K+、NH![]() 、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示.
、Mg2+和Cu2+等离子中的一种或几种.现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀.如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示.
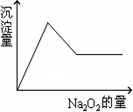
试推断:原溶液中一定含有________;一定没有________,可能含________,为了进一步确定可能含有的离子,应增加的实验操作为________,现象为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com