
科目: 来源:上海市普陀区2013年高考一模化学试题 题型:022
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)完成下列填空:
1、某温度下该反应在一容积为2 L的密闭容器中进行,2 min后达到平衡,刚好有2 mol电子发生转移,则2 min内反应的速率为:v(CO)=________;该反应的平衡常数表达式为________.
2、其它条件不变时仅增大压强,则________.
a.K值减小,平衡向逆反应方向移动
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动
d.K值不变,平衡向正反应方向移动
3、一定条件下能说明上述反应已达平衡的是________.
a.c(N2)∶c(CO)=1∶3
b.3v(N2)=v(CO)
c.固体质量不再改变
d.气体密度不再改变
4、达到平衡后改变某一条件,反应速率v与时间t的关系如下图所示.若不改变N2与CO的量,则图中t4时引起变化的原因可能是________;图中t6时引起变化的原因可能是________.

由图可知,平衡混合物中CO含量最高的时间段是________.
查看答案和解析>>
科目: 来源:上海市普陀区2013年高考一模化学试题 题型:022
铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强.工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
1、含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
________Cr2O72-+________Fe3O4+________H+→________Cr3++________Fe3++________H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目.
2、向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀.写出从该沉淀中分离出Cr(OH)3的离子方程式________、________.
3、回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7.纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
①Cr2O72-+6I-+14H+→3I2+2Cr3++7H2O
②2S2O32-+I2→S4O62-+2I-
准确称取纯净的K2Cr2O70.1225 g,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00 mL.则Na2S2O3溶液的物质的量浓度为________(保留四位有效数字).
查看答案和解析>>
科目: 来源:上海市普陀区2013年高考一模化学试题 题型:022
2007年8月《地球学报》杂志报道,利用氮、氧及氮、硼同位素技术,通过测定可知地下硝酸盐来源的水污染情况.
完成下列填空:
1、关于14N与15N的正确说法是________;
a、自然界氮元素中14N的含量:空气中大于地壳中
b、单质:14N2与15N2互为同位素
c、电子层结构:14N与15N完全相同
d、原子半径:14N小于15N
与N元素同周期且最外层有2个未成对电子的元素相互组成的化合物属于________分子.(填:“极性”、“非极性”、“极性或非极性”)
2、NH3与H2O分别能与H+结合成NH4+与H3O+.与NH4+具有相同空间构型的微粒是________;
a、H3O+
b、CH4
c、P4
d、NH3
分子中的键角:CH4________P4(填:“>”、“=”或“<”).
3、H3O+与NH4+的水溶液均显酸性.用离子方程式表示NH4+水溶液显酸性的原因:________.
4、使用N、O、B同位素,并结合水化学分析,将更有利于对测定结果的解释.写出B原子的最外层电子排布式________;B原子核外的电子处在________个不同的能级上.
查看答案和解析>>
科目: 来源:上海市杨浦区2013年高考一模化学试题 题型:022
DEHP是一种应用广泛的塑料增塑剂.DEHP有如下的转化关系.
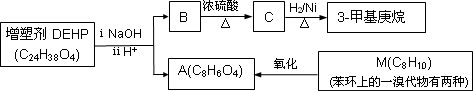
完成下列填空:
1.M的结构简式是________.A分子中所含官能团的名称是________.
2.B分子中有1个碳原子连接的烷基是乙基和正丁基.B的结构简式是________.
3.化合物C的名称是________.
4.F是A的一种同分异构体,具有下列特征:
a.是苯的邻位二取代物
b.遇氯化铁溶液显紫色
c.能与碳酸氢钠溶液反应
写出F与足量碳酸氢钠溶液反应的化学方程式________.
查看答案和解析>>
科目: 来源:上海市杨浦区2013年高考一模化学试题 题型:022
Cl2合成有机物时会产生副产物HC1.4HCl+O2![]() 2Cl2+2H2O,可实现氯的循环利用.
2Cl2+2H2O,可实现氯的循环利用.
完成下列填空:
1.该反应平衡常数的表达式K=________;若反应容器的容积为2 L,8 min后达到平衡,测得容器内物质由2.5 mol减少至2.25 mol,则HCl的平均反应速率为________mol/L·min.
2.若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是________.
a.v(HCl)=2v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1 mol O2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
3.下图是该反应两种投料比[n(HCl)∶n(O2)分别为4∶1和2∶1]下,反应温度对HCl平衡转化率影响的曲线.下列叙述正确的是________.

a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
4.投料比为4∶1、温度为400℃时,平衡混合物中Cl2的物质的量分数是________.
查看答案和解析>>
科目: 来源:上海市杨浦区2013年高考一模化学试题 题型:022
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称.
完成下列填空:
1.将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42-等.写出该反应的化学方程式________.
2.向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-.写出并配平该反应的离子方程式,并标出电子转移的数目和方向________.
3.在20.00 mL的0.1 mol/L VO2+溶液中,加入0.195 g锌粉,恰好完成反应,则还原产物可能是________.
a.V
b.V2+
c.VO2+
d.VO2+
4.已知V2O5能和盐酸反应生成氯气和VO2+.请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+________.
查看答案和解析>>
科目: 来源:上海市杨浦区2013年高考一模化学试题 题型:022
镁铝尖晶石(MgAl2O4)常做耐火材料.共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧.
完成下列填空:
1.为使Mg2+、Al3+同时生成沉淀,应该把________(填“a”或“b”)滴入另一溶液中.
2.将上述制备反应中部分元素的简单离子:Al3+、Cl-、Mg2+、H+、O2-按半径由大到小的顺序排列________(用离子符号表示).
3.AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是________,属于难溶物的电离方程式________.
4.不能说明氧元素的非金属性比氮元素强的事实是________.
a.H2O比NH3稳定
b.共用电子对偏向:H-O>H-N
c.沸点:H2O>NH3
d.NO中氮是+2价,氧是-2价
查看答案和解析>>
科目: 来源:北京市海淀区2012届高三5月查漏补缺化学试题 题型:022
|
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、OH-、Cl-、HCO3-、H+、SO42-中的不同阳离子和阴离子各一种组成.已知: ①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成; ②0.1 mol/L乙溶液中c(H+)>0.1 mol/L; ③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成. 下列结论不正确的是 | |
| [ ] | |
A. |
甲溶液含有Ba2+ |
B. |
乙溶液含有SO42- C丙溶液含有Cl- |
查看答案和解析>>
科目: 来源:北京市海淀区2012届高三5月查漏补缺化学试题 题型:022
|
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示.下列有关说法正确的是
| |
| [ ] | |
A. |
a点由水电离出的c(H+)=1.0×10-14 mol/L |
B. |
a点时溶液的Kw小于d点时溶液的Kw |
C. |
b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
D. |
d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com