
科目: 来源:上海市奉贤区2013年高考一模化学试题 题型:022
某体系中存在如下反应:
①H2S+4H2O-8e→SO42-+10H+
②2IO3-+12H++10e→I2+6H2O
1.反应①中H2S做________剂,反应②属于________反应(填“氧化”或“还原”).
2.若在反应①中失去0.2 mol电子,则反应②中可生成________ g I2.
3.写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:________.
4.由上述反应可推知________.
a.氧化性:K2SO4>KIO3
b.酸性:HIO3>H2SO4
c.还原性:H2S>I2
d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目: 来源:上海市奉贤区2013年高考一模化学试题 题型:022
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:

1.W位于元素周期表第________周期第________族,其原子最外层有________个电子.
2.X的活泼性比Y的________(填“强”或“弱”);X和Y的气态氢化物中,较稳定的是________(写化学式).
3.写出Z2Y2的电子式________,XY2的结构式________.
4.在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称________.氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式________.
查看答案和解析>>
科目: 来源:上海市宝山区2013年高考一模化学试题 题型:022
二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,用途十分广泛.二甘醇一般的合成路线如下:
1.过程Ⅰ是石油加工中常用步骤,其名称为________;从物质B到物质C的反应条件Ⅱ是________,该反应属于________(填写反应类型);物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出B可能生成E的化学方程式________.
2.写出上述合成路线中的物质A、B、C的结构简式:A________;B________;C________.
3.反应Ⅲ的化学方程式为:________.
查看答案和解析>>
科目: 来源:上海市宝山区2013年高考一模化学试题 题型:022
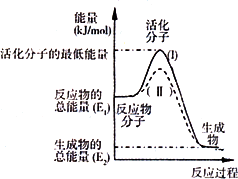
已知反应:3I-(aq)+S2O82-(aq)![]() I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
1.写出反应的平衡常数表达式:K=________.
2.下图表示反应过程中有关物质的能量,则反应过程中的Q________0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是________曲线.
3.反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.下表是在20℃进行实验时所记录的数据
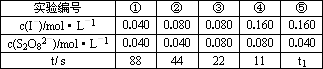
从表中数据分析,该实验的目的是________;________表中显色时间t1=________s;最终得出的结论是________.
查看答案和解析>>
科目: 来源:上海市宝山区2013年高考一模化学试题 题型:022
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关.
Ⅰ.一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3→HNO3+N2 +H2O(未配平)
1.该反应中发生还原反应的过程是________→________.
2.反应中被氧化与被还原的氮原子数之比为________;现有1 mol NH4NO3分解,生成的氧化产物的物质的量是________mol.
Ⅱ.硝酸铵受撞击或高温发生爆炸的化学反应方程式为:mNH4NO3→nO2+pN2+qH2O
3.下列关于该方程式中化学计量数的说法正确的是________(选填字母编号).
a.m=1
b.n=2
c.p=3
d.q=4
4.若反应过程中共转移3.01×1023个电子,则反应可产生气体的体积为________(标准状况).
查看答案和解析>>
科目: 来源:上海市宝山区2013年高考一模化学试题 题型:022
已知X、Y、Z、L四种元素是组成蛋白质的基础元素且原子序数依次增大.回答下列问题:
1.L的元素符号为________;Y元素原子核外电子中,未成对电子数与成对电子数之比为________;四种元素的原子半径从大到小的顺序是________(用元素符号表示).
2.Z、X两元素按原子数目比1∶3可构成分子A,A的电子式为________;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为________.若64 g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000 kJ的热量,写出该反应的热化学方程式________.
3.硒(Se)是人体必需的微量元素,与元素L同一主族,该族第2~5周期元素单质分别与H2反应生成l mol气态氢化物产生的热量数据如下,其中能表示生成1 mol硒化氢所产生的热量的是________(选填字母编号).
a.-99.7 kJ
b.-29.7 kJ
c.+20.6 kJ
d.+241.8 kJ
查看答案和解析>>
科目: 来源:上海市徐汇区2013年高考一模试卷化学试题 题型:022
化合物Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ
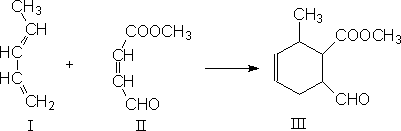
化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
1.a的结构简式是________,②步的反应类型是________.
2.化合物Ⅰ的一种同分异构体是天然橡胶的单体,用系统命名法命名该单体________.
3.化合物Ⅰ与II反应还可能得到III的一种同分异构体,该物质的结构简式为________.
4.欲检验化合物Ⅲ中的碳碳双键,正确的试剂是________.
查看答案和解析>>
科目: 来源:上海市徐汇区2013年高考一模试卷化学试题 题型:022
甲酸甲酯水解反应方程式为:HCOOCH3+H2O![]() HCOOH+CH3OH-Q(Q>0)某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如下表.甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
HCOOH+CH3OH-Q(Q>0)某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如下表.甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
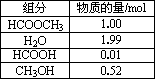
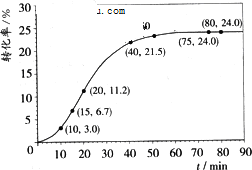
1.上述反应的平衡常数表达式为K=________.
2.计算15~20 min范围内:甲酸甲酯的减少量为________mol,甲酸甲酯的平均反应速率为________mol/min;80~90 min范围内甲酸甲酯的平均反应速率为________mol/min.
3.依据以上数据,推断该反应在10 min后反应速率迅速加快的原因:________.
4.其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
查看答案和解析>>
科目: 来源:上海市徐汇区2013年高考一模试卷化学试题 题型:022
已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色.取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生.
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色.
回答下列问题:
1.写出实验①反应的离子方程式:________.
2.KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________.
3.向反应③得到的溶液中通入SO2气体,看到的现象是________.
4.若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为________mol.
查看答案和解析>>
科目: 来源:上海市徐汇区2013年高考一模试卷化学试题 题型:022
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强. 下面是某些短周期元素的x值:
1.通过分析x值变化规律,确定Mg的x值范围:________<x(Mg)<________.
2.推测x值与原子半径的关系是________;根据短周期元素的x值变化特点,体现了元素性质的________变化规律.
3.分别指出下列两种化合物中氧元素的化合价:HClO________,HFO________.
4.经验规律告诉我们:当成键的两原子相应元素x数值的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________.
5.预测元素周期表中,x值最小的元素位于________周期________族(放射性元素除外).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com