
科目: 来源:江苏省徐州市2012届高三考前信息卷化学试题 题型:022
原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.
(1)元素W的电子排布式为________.
(2)X、Y与氢元素形成的化合物XH2-YH中采用sp3杂
化的原子有________,1 mol XH2-YH中含有σ键的数
目为________.
(3)ZO4-离子的空间构型为________,与它互为等电子体的离子有________.
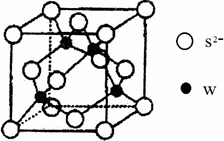
(4)元素W的一种硫化物晶体的晶胞结构如右上图所示,该硫化物的化学式是________.元素W的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式:________.
查看答案和解析>>
科目: 来源:江苏省徐州市2012届高三考前信息卷化学试题 题型:022
新型液流式铅酸蓄电池是二次电池,以甲基磺酸铅[Pb(CH3SO3)2]溶液为电解液,正极板上覆盖PbO2,负极板上覆盖Pb.电池总反应为:
Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
(1)甲基磺酸铅可通过下列方法制备:以50%~58%的甲基磺酸(CH3SO3H)为电解液,分别以金属铅和石墨做电极,进行电解即可制得.电解时,该电解池阳极为
________;总反应方程式为________.
(2)铅酸蓄电池也存在缺点,主要有比能量低、________.(任答一条)
(3)利用高锰酸钾测定某铅氧化物样品(Pb的化合价有+2、+4价)中铅元素含量,具体步骤为:称取样品0.7340 g,加入足量草酸还原+4价的Pb,调节溶液的pH,使Pb2+全部沉淀为PbC2O4;过滤、洗涤后将沉淀完全溶于适量酸中;用0.0400 mol·L-1 KMnO4标准溶液滴定,达滴定终点时,消耗KMnO4溶液30.25 mL(假设只发生反应:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O).试计算样品中铅元素的质量分数.
查看答案和解析>>
科目: 来源:江苏省徐州市2012届高三考前信息卷化学试题 题型:022
利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下:
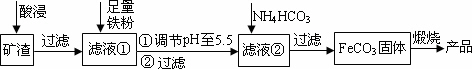
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为________.为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有________、
________.(任举两例)
(2)调节pH至5.5的目的是________.
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是________.(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为________.
查看答案和解析>>
科目: 来源:上海市嘉定区2013年高考一模化学试题 题型:022
已知:有机物D(C4H7NO4)是组成人体蛋白质的氨基酸之一,它可由A通过以下反应合成制取.有机物A(C6H8O4)为食品包装中的常用防腐剂,常温下难溶于水,可以使溴水褪色.有机物B(C4H4O4),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应.
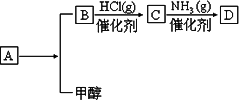
请回答下列问题:
1、B、D的结构简式分别是________、________.
2、A可以发生的反应有________(选填序号)
①加成反应
②氧化反应
③酯化反应
④加聚反应
3、B分子中所含的官能团名称是________.
4、B的具有相同官能团的同分异构体的结构简式是________.
5、写出由B与甲醇反应制A的化学方程式是________.
查看答案和解析>>
科目: 来源:上海市嘉定区2013年高考一模化学试题 题型:022
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
1、常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2.则m1________m2(选填“<”、“=”、“>”)
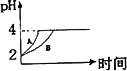
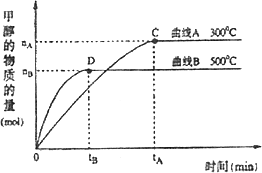
2、在体积为3 L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).反应达到平衡时,平衡常数表达式K=________,升高温度,K值________(填“增大”、“减小”或“不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________.
3、常温下,某纯碱溶液中滴入酚酞,溶液呈红色.说明该溶液呈________性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)________.
查看答案和解析>>
科目: 来源:上海市嘉定区2013年高考一模化学试题 题型:022
已知33As、35Br位于同一周期.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
1、已知KBrO3在反应中得到电子,则该反应的还原剂是________.已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是________.
2、在该反应条件下可推知________(填序号).
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>A sH3
3、该反应的氧化剂和还原剂的物质的量之比为________;KBrO3与HBr反应也会生成X,则该反应中氧化剂和还原剂的物质的量之比为________.
查看答案和解析>>
科目: 来源:上海市嘉定区2013年高考一模化学试题 题型:022
氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
1.上述五中物质中沸点最低物质的结构式为________,由上述物质中的两种元素按原子个数比1∶1形成的离子化合物的电子式为________(写一例)
2.Al元素的单质有许多不同于其他金属的特性,请列举2例(也可以用化学方程式表示)________、________.
3.氢有3种稳定同位素,H氕、D氘、T氚,分别为丰度a、b、c,则计算氢元素的近似相对原子质量的表达式为________.
甲认为H可以排在周期表ⅠA族,也可以排在ⅦA族;而乙同学认为H也可以与碳一样,排在ⅣA族,乙同学的理由是________.
4.己知通入二氧化碳336 L(标准状况下),理论上生成Al(OH)3________mol,实际上生成24 mol Al(OH)3和15 mol Na2CO3,Al(OH)3比理论上要少的原因是:________.
查看答案和解析>>
科目: 来源:上海市奉贤区2013年高考一模化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:上海市奉贤区2013年高考一模化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com