
科目: 来源:上海市闵行区2013年高考一模化学试题 题型:022
已知有机物A是一种重要的有机化工基础原料,过氧乙酸(![]() )是一种强氧化剂.以下是以有机物A为原料合成己内酯的路线示意图:
)是一种强氧化剂.以下是以有机物A为原料合成己内酯的路线示意图:
2A![]() CH2=CH-C≡CH
CH2=CH-C≡CH![]() CH2=CH-CH=CH2
CH2=CH-CH=CH2![]() B
B![]()
![]()
![]()
![]()
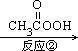
![]() (己内酯)
(己内酯)
完成下列填空:
1.A的电子式为________,反应②的反应类型是________.
2.B的结构简式为________.
3.己内酯有多种异构体,写出能同时满足下列要求的物质结构简式________.
①能发生银镜反应;②能发生水解反应;③能使溴的四氯化碳溶液褪色;④分子结构中有三个甲基.
4.写出由CH2=CH-C≡CH合成氯丁橡胶(![]() )的有关化学反应方程式.
)的有关化学反应方程式.
查看答案和解析>>
科目: 来源:上海市闵行区2013年高考一模化学试题 题型:022
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点–54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g)1.试写出常温常压下化学平衡常数K的表达式:K=________;
若在此条件下,将化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是________(选填编号).
a.降低温度
b.移走SO2Cl2
c.增加反应物浓度
d.无法满足上述条件
2.为了提高上述反应中Cl2的平衡转化率,下列措施合理的是________(选填编号).
a.缩小容器体积
b.使用催化剂
c.增加SO2浓度
d.升高温度
在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有________(选填编号).
a.只有37Cl2
b.只有SO237Cl2
c.37Cl2和SO237Cl2
d.无法判断
3.下列描述中能说明上述反应已达平衡的是________(选填编号).
a.v(Cl2)=v(SO2)
b.容器中气体压强不随时间而变化
c.c(Cl2)∶c(SO2)=1∶1
d.容器中气体颜色不随时间两变化
4.300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO27.616 g.若在上述中的平衡体系中,再加入16.20 g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________.
查看答案和解析>>
科目: 来源:上海市闵行区2013年高考一模化学试题 题型:022
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.
1.下列生产、生活中的事例中没有发生氧化还原反应的是________(选填编号).
a.煤的形成
b.原电池工作
c.简单机械织布
d.我国古代烧制陶器
2.水是人体的重要组成部分,是人体中含量最多的一种物质.“四种基本反应类型与氧化还原反应的关系”可用下图表示.

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________.
工业上利用NaIO3和NaHSO3反应来制取单质I2.
3.配平下列化学方程式并标明电子转移的方向和数目:
________NaIO3+________NaHSO3![]() ________I2+________Na2SO4+________H2SO4+________H2O
________I2+________Na2SO4+________H2SO4+________H2O
4.已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的________反应,离子方程式为________.
查看答案和解析>>
科目: 来源:上海市闵行区2013年高考一模化学试题 题型:022
根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2↑.
Na2SO4+Na2SnS3+2CO2↑.
回答下列问题:
1.上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为________.在上述反应的生成物中,属于分子晶体的结构式________.
2.在上述反应中单质物质的原子核外共有________种不同运动状态的电子,有________种不同能量的电子.
3.上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是________(选填编号).
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
4.常温下,测得Na2SnS3溶液pH>7,请用离子方程式表示其原因:________.
查看答案和解析>>
科目: 来源:上海市黄浦区2013年高考一模化学试题 题型:022
工业上高纯硅可以通过下列反应制取:
SiCl4(g)+2H2(g)完成下列填空:
1.在一定温度下进行上述反应,若反应容器的容积为2 L,H2的平均反应速率为0.1 mol/(L·min),3 min后达到平衡,此时获得固体的质量________g.
2.该反应的平衡常数表达式K=________.可以通过________使K增大.
3.一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是________.
a.2v逆(SiCl4)=v正(H2)
b.断开4 mol Si-Cl键的同时,生成4 mol H-Cl键
c.混合气体密度保持不变
d.c(SiCl4)∶c(H2)∶c(HCl)=1∶2∶4
4.若反应过程如下图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是________,第3分钟改变的条件是________,各平衡态中氢气转化率最小的时间段是________.
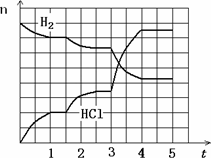
查看答案和解析>>
科目: 来源:上海市黄浦区2013年高考一模化学试题 题型:022
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO.完成下列填空:
1.该反应中氧化剂是________,氧化产物是________.
2.写出该反应的化学方程式________.
3.每消耗24.0 g碳时,有________mol电子发生转移,生成P4________g.
4.反应所得混合气体,折算成标况下,其气体密度为________g/L.
查看答案和解析>>
科目: 来源:上海市黄浦区2013年高考一模化学试题 题型:022
现有1-20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:

1.元素A的原子最外层共有________种不同运动状态的电子,有________种能量不同的电子.B的离子与D的离子相互组合形成的干燥剂的化学式是________.
2.元素C与氢元素形成带一个单位正电荷的离子,写出该微粒的电子式(用元素符号表示)________.
3.元素A与元素D相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是
A.常温下A的单质和D的单质状态不同
B.A的氢化物比D的氢化物稳定
C.一定条件下D能从A的氢化物水溶液中置换出A单质
D.HD的酸性比HA酸性强
4.C的氢化物固态时属于________晶体,该氢化物与A的最高价氧化物水化物反应的化学方程式是________.
查看答案和解析>>
科目: 来源:上海市奉贤区2012届高三4月调研考试(二模)化学试题 题型:022
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.该法的工艺流程为
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
1.若平衡体系的pH=2,则溶液显________色.
2.能说明第①步反应达平衡状态的是________.
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
d.溶液的pH值不变
3.第②步中,还原0.01 mol Cr2O72-离子,需要________mol的FeSO4·7H2O.
4.许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H++CrO2-(亮绿色)+H2O![]() Cr(OH)3(s)
Cr(OH)3(s)![]() Cr3+(紫色)+3OH-
Cr3+(紫色)+3OH-
下列有关说法中正确的是________
a、加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b、在一定条件下存在:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c、Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中的存在叁个平衡
查看答案和解析>>
科目: 来源:上海市奉贤区2012届高三4月调研考试(二模)化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com