
科目: 来源:2008年中山纪念中学5月份化学模拟试题 题型:022
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)![]() 3NH3(g)ΔH=-92.2 kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂——铁触媒,温度-400~500℃,压强-30~50 MPa.回答下列问题:
3NH3(g)ΔH=-92.2 kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂——铁触媒,温度-400~500℃,压强-30~50 MPa.回答下列问题:
(1)合成氨工业中原料气压缩到30~50 MPa的原因是________________.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是________________.
(2)500℃、50 MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x.则K和x的关系满足K=________________.
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g).部分物质的燃烧热数据如下表:
CO(g)+3H2(g).部分物质的燃烧热数据如下表:

已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量.写出CH4和H2O在高温下反应的热化学方程式_______________.
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式_______________.
查看答案和解析>>
科目: 来源:2008年中山纪念中学5月份化学模拟试题 题型:022
某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据:(表中某些数据记录已模糊不清,个别数据已丢失.)
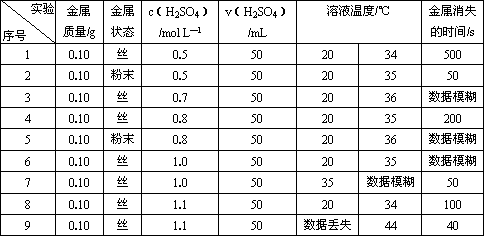
若实验操作、数据记录均是正确的,请分析上述数据,回答下列问题:
(1)该实验主要是探究________因素对反应速率的影响.
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理.
(3)试猜测实验9反应前溶液的温度约为________℃.推测的依据是________.
查看答案和解析>>
科目: 来源:北京市海淀区2007~2008学年度高三年级第一学期期中练习、化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:北京市海淀区2007~2008学年度高三年级第一学期期中练习、化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:北京市海淀区2007~2008学年度高三年级第一学期期中练习、化学试题 题型:022
某课外活动小组进行电解饱和食盐水的实验(如图).请回答下列问题:
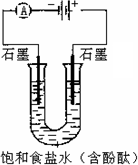
(1)通电一段时间后,可观察到________电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为________.
(2)该溶液电解反应的化学方程式为________.
(3)若开始时改用铁棒做阳极,阳极的电极反应式为________.
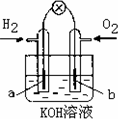
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电.其中a是________极(填“正”或“负”).b极的电极反应式为________.
查看答案和解析>>
科目: 来源:北京市海淀区2007~2008学年度高三年级第一学期期中练习、化学试题 题型:022
某有机物A(相对分子质量为74)可在一定条件下氧化成无支链的B(碳原子数不变),转化关系如图所示(部分反应条件和产物略),其中有机物G的分子结构中不含溴.

(1)A的分子式为________,B中含有的官能团名称为________.D的结构简式为________.
(2)A→E反应的化学方程式为________.
F→G的反应类型为________.
(3)E在一定条件下可加聚生成聚合物H,H的结构简式为________.
(4)与A同类的所有同分异构体的结构简式为:
________________________________________________________.
查看答案和解析>>
科目: 来源:唐山市2006-2007学年度高三年级第一次模拟考试 化学部分 题型:022
| |||||||||||||||
查看答案和解析>>
科目: 来源:山东省淄博市2006-2007学年度高三年级第二次摸底考试化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:淄博市2006-2007学年度高三第二次摸底考试、化学试题 题型:022
| |||||||||||||||
查看答案和解析>>
科目: 来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com