
科目: 来源:2007-2008江苏省秋实学苑期中考试化学试卷 题型:022
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取.
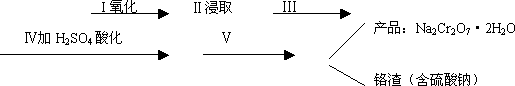
①步骤Ⅰ中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2=8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为________,在常温下该反应速度极慢,下列措施中能使反应速率增大的是________.
A.升高温度
B.通入过量的空气
C.将原料粉碎
D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是________、________.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是________.
④步骤Ⅳ中发生反应的离子方程式为:________.
(2)将红矾钠与KCl固体1∶2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格.完成上述过程.

查看答案和解析>>
科目: 来源:2007-2008江苏省秋实学苑期中考试化学试卷 题型:022
某研究性学习小组探究下列化学反应的特征:
(Ⅰ)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(Ⅱ)FeS+HNO3→Fe(NO3)3+Fe2(SO4)3+NO2↑+N2O4↑+NO↑+H2O
(Ⅲ)CuSO4→CuO+SO3↑+SO2↑+O2↑
(Ⅳ)CO2+KOH→KHCO3+K2CO3+H2O
(1)大多数化学反应中物质的化学计量数之比是固定的,但上述化学反应的化学计量数之比是不确定的,即物质的化学计量数有多组.根据上述实例,请用一句话归纳化学计量数有多组的化学反应的特点:________.
(2)反应(Ⅱ)中还原产物是________,若其物质的量之比确定,该反应的化学计量数也随之确定.
(3)有人认为反应(Ⅲ)是两个反应式加合的结果,请分析它是哪两个化学反应加合而成的:________、________.在反应(Ⅲ)中,根据电子转移守恒,物质________和________的物质的量之比是固定的.
(4)若将16gCuSO4固体粉末按反应(Ⅲ)完全分解,最终气体产物的物质的量的取值范围是:________.
(5)若反应(Ⅳ)中KHCO3、K2CO3的化学计量数分别为a、b,则用a、b表示该反应的化学计量数的化学方程式是________.
查看答案和解析>>
科目: 来源:2007-2008江苏省秋实学苑期中考试化学试卷 题型:022
胃酸过多是常见的胃病.下面是甲、乙两种常见胃药的说明摘要.
甲:①白色结晶状粉末,受热可缓缓分解;②能溶于水,水溶液呈弱碱性;灼烧时火焰为黄色;③遇酸及酸性药物则产生二氧化碳;④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险.
乙:①与胃酸是中和作用缓慢而持久,可维持3~4小时;②凝胶本身覆盖于溃疡面上,具有保护作用;③可溶于稀酸或氢氧化钠溶液中.
(1)请你推测,甲中含有的主要化学成份是________(填化学式);乙中含有的主要化学成份是________(填化学式).
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:________.
(3)三硅酸镁Mg2Si3O8·nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久.把三硅酸镁改写成氧化物形式为:________.
写出它中和胃酸(胃酸的主要成分是HCl)的化学方程式________.
(4)目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成(说明:Mg(OH)2在高温下分解为MgO).现按如下步骤测定药剂中三种主要成分的配比:
①取药剂样品,研磨后,加入50 mL 3.6 mol·L-1盐酸,正好完全反应并收集得到标准状况下224 mL气体
②过滤,弃去其中不溶性物质(其余成分不参与反应)
③取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4 g.
则该药剂中三种主要成分的物质的量之比为n(MgCO3)∶n(Mg(OH)2)∶n(Al(OH)3)=________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(天津卷)、理综化学部分及答案 题型:022
称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液.量取两份此溶液各25 mL,分别置于两个锥形瓶中.
①第一份溶液中加入酚酞试液,滴加0.25 mol/LNaOH溶液至20 mL时,溶液由无色变为浅红色.该溶液被中和的H+的物质的量为________mol.
②第二份溶液中滴加0.10 mol/L的酸性高锰酸钾溶液至16 mL时反应完全,此时溶液颜色由________变为________.该溶液中还原剂的物质的量为________mol.
③原试样中H2C2O4·2H2O的质量分数为________.KHC2O4的质量分数为________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(天津卷)、理综化学部分及答案 题型:022
某天然有机化合物A仅含C、H、O元素,与A相关的反应框图如下:
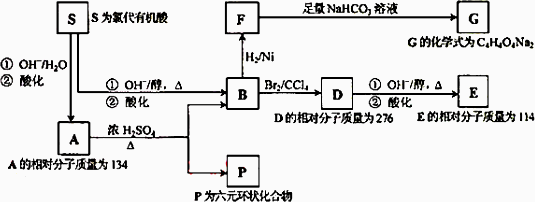
(1)写出下列反应的反应类型:
S→A第①步反应________、B→D________、
D→E第①步反应________、A→P________.
(2)B所含官能团的名称是_________.
(3)写出A、P、E、S的结构简式
A:________、P:________、E:________、S:________.
(4)写出在浓H2SO4存在并加热的条件下,F与足量乙醇反应的化学方程式________.
(5)写出与D具有相同官能团的D的所有同分异构体的结构简式________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(天津卷)、理综化学部分及答案 题型:022
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为________.
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________.
(3)X的硝酸盐水溶液显________性,用离子方程式解释原因________.
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为________.
(5)比较Y、Z气态氢化物的稳定性________>________(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
________>________>________>________.
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QKj的热量.写出该反应的热化学方程式:________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(江苏卷)、化学 题型:022
将一定量的SO和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2![]() 2SO3(正反应放热).反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)
2SO3(正反应放热).反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是________.(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是________.(填字母)
a.向装置中再充入N2
b.向装置中再充入O2
c.改变反应的催化剂
d.生高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示).
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(江苏卷)、化学 题型:022
布噁布洛芬是一种消炎镇痛的药物.它的工业合成路线如下:
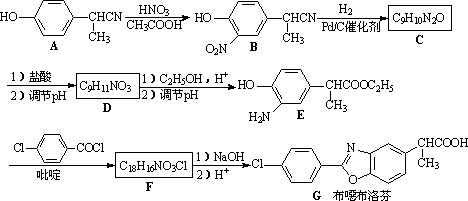
请回答下列问题:
(1)A长期暴露在空气中会变质,其原因是________________.
(2)有A到B的反应通常在低温时进行.温度升高时,多硝基取代副产物会增多.下列二硝基取代物中,最可能生成的是________.(填字母)
a.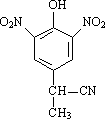 b.
b.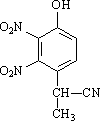 c.
c.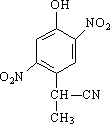 d.
d.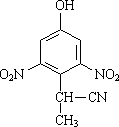
(3)在E的下列同分异构体中,含有手性碳原子的分子是________.(填字母)
a.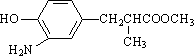
b.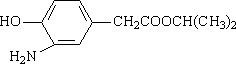
c.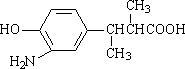
d.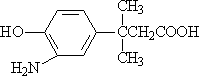
(4)F的结构简式________________.
(5)D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,则H的结构简式是________.高聚物L由H通过肽键连接而成,L的结构简式是________________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(江苏卷)、化学 题型:022
“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
(1)下列措施中,有利于降低大气中CO2浓度的有:________.(填字母)
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6
C6H12O6
b.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2
CH2![]() CH2+4H2O
CH2+4H2O
以上反应中,最节能的是________,原子利用率最高的是________.
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
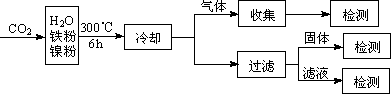
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.
CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):

研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,即:CO2![]() HCOOH
HCOOH![]() CH4
CH4
①写出产生H2的反应方程式________.
②由图可知,镍粉是________.(填字母)
a.反应的催化剂
b.反应的催化剂
c.反应的催化剂
d.不是催化剂
③当镍粉用量从1 m mol增加到10 m mol,反应速率的变化情况是________________.(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应ⅠⅡ的速率均不变
d.反应ⅠⅡ的速率均增加,且反应Ⅰ的速率增加得快
e.反应ⅠⅡ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(江苏卷)、化学 题型:022
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
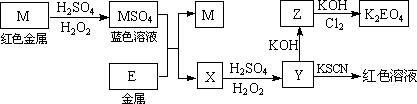
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:________________.
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色.写出与上述变化过程相关的离子方程式:________________、________________.
(3)写出Cl2将Z氧化为K2EO4的化学方程式:________________.
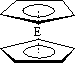
(4)由E制备的E(C2H5)2的结构如下图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为:![]() .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有________种峰,错误的结构有________种峰.
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有________种峰,错误的结构有________种峰.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com