
科目: 来源:河北衡水中学2008-2009学年度高三上学期期中考试(化学) 题型:022
元素周期表中的六种元素①②③④⑤⑥位置如下图所示:
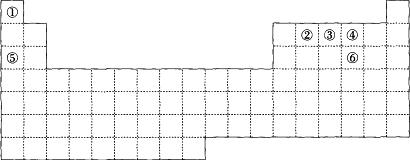
回答下列问题:
(1)由②④⑤三种元素组成的无机物(相对分子质量106),其水溶液呈碱性,用离子方程式表示其原因________.
(2)只含①③④三种元素的一种常见离子化合物中,元素③的化合价分别处于最高价和最低价,则其水溶液中离子浓度的由大到小顺序为________.
(3)元素③的氢化物与元素④单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为________.
(4)用惰性电极电解元素⑥的最高价氧化物对应水化物的稀溶液,阳极的电极反应式为________.
(5)由④⑤形成的原子个数1∶1的化合物的电子式为________.
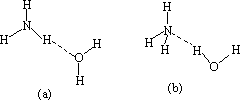
(6)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是:________
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是:________
(7)利用稀有气体化合物,人们实现了许多制备实验的突破,如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时释放出Xe,写出上述反应的离子方程式:________
查看答案和解析>>
科目: 来源:赣州一中2008~2009学年上学期期中考试高三化学试卷 题型:022
有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;④G是除氢外原子半径最小的元素.
(1)A的名称是________,B位于周期表中第________周期________族,C的原子结构示意图是________,F的元素符号是________.
(2)A元素与D元素形成化合物的电子式是________.
(3)G的单质与水反应的化学方程式是________.
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是________,酸性最强的化学式是________,气态氢化物最稳定的化学式是________.
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是:________.
查看答案和解析>>
科目: 来源:北京市海淀区2009届高三年级第一学期期中练习化学试题 题型:022
A和R在一定条件下可合成芳香族化合物E,已知A可以在一定条件下转化为G,且G在标准状况下密度为1.25 g/L.各物质间相互转化关系如下图所示(某些条件已略去).
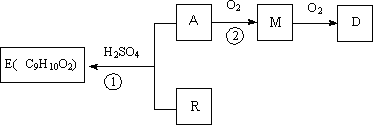
(1)A中所含官能团的名称为________;①的反应类型为________.
(2)②的化学反应方程式为________.
M与新制氢氧化铜悬浊液反应的化学方程式________.
(3)与E具有相同官能团,且苯环上只有一个取代基的同分异构体还有5种,它们是:
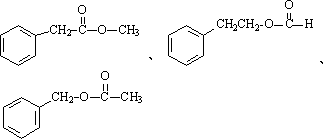
________、________.
查看答案和解析>>
科目: 来源:北京市海淀区2009届高三年级第一学期期中练习化学试题 题型:022
在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)![]() pC(g)+qD(g).
pC(g)+qD(g).
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质________mol.
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图所示.则T1(填“>”、“<”或“=”)________T2,该反应的正反应的ΔH(填“>”、“<”或“=”)________0.
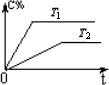
(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如图所示,测得达到平衡时A、B、C、D的物质的量均为1 mol.
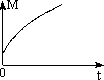
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D 1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)________.
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)________.
查看答案和解析>>
科目: 来源:北京市海淀区2009届高三年级第一学期期中练习化学试题 题型:022
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________.
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是________.
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)________25℃.在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________.
查看答案和解析>>
科目: 来源:深圳外国语学校2008届高三年级第二次质量检测化学试卷 题型:022
下图表示一些常见物质间的相互转换关系,其中C、E都是金属单质,常温下H为无色液体,C与B的稀溶液不反应,B与K是同一类别的物质,在无色灯焰中灼烧F和L时火焰均为黄色.将新制M的悬浊液与病人尿液共热,能诊断病人是否患有糖尿病.试回答:
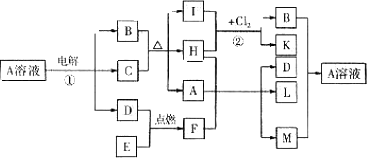
(1)F的电子式为________;反应①的阳极反应式为________.
(2)反应②的化学方程式为________.
(3)B溶液与M反应的离子方程式为________.
(4)I与F有一项相同的用途是________.
(5)新制M的悬浊液与葡萄糖共热至沸腾,发生反应的化学方程式为________.
查看答案和解析>>
科目: 来源:深圳外国语学校2008届高三年级第二次质量检测化学试卷 题型:022
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、MnO4-、Cl-、I-、NO3-、CO32-、S2-、SO42-、、SO32-、AlO2-中的几种.取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性,可排除________离子的存在.
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色,可排除________离子的存在.
(3)另取部分溶液,逐滴向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生.则又可排除________离子的存在.
(4)取部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明有________离子存在,又可排除________离子的存在.
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
根据上述实验事实确定:①该溶液中肯定存在的离子是________;还不能确定是否存在的离子是________.
查看答案和解析>>
科目: 来源:深圳外国语学校2008届高三年级第二次质量检测化学试卷 题型:022
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸.
(1)请写出并配平上述反应的化学方程式________.
(2)此反应的还原剂是________,它的氧化产物是________.
(3)此反应的离子反应方程式可表示为:________.
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还可能有(填一种)________.
查看答案和解析>>
科目: 来源:江苏海安立发中学2008届高三第二次阶段检测化学试题 题型:022
在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)![]() 3C(g)+D(s),反应达到平衡时C的浓度为1.2 mol/L.
3C(g)+D(s),反应达到平衡时C的浓度为1.2 mol/L.
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是________(用序号填空)
①4 mol A+2 mol B
②3 mol C+1 mol D+l mol B
③3 mol C+2 mol D
④1.6 mol A+0.8 mol B+0.6 mol C
(3)向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于________L,小于________L.
(4)若设容器体积为1 L,温度不变,反应从逆反应开始(反应物只有C和D),按不同的配比作为起始物质,达到平衡时,C的浓度仍为1.2 mol/L,则D的起始物质的量应满足的条件是________.
查看答案和解析>>
科目: 来源:江苏海安立发中学2008届高三第二次阶段检测化学试题 题型:022
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
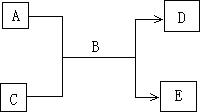
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E﹥D,则:
该反应的反应方程式为________,
检验D中阴离子的方法是________.
(2)若A为短周期的金属单质,D为气态单质,C溶液呈强酸性或强碱性时,该反应都能进行.写出反应的离子方程式________;
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的化学式(写两种)________、________.
写出生成E的一个离子方程式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com