
科目: 来源:江苏省南京六中2008-2009学年度高三第一学期期中考试 化学试卷 题型:022
下表是元素周期表主族元素的一部分.
短周期元素X的最高正价是+5价,Y单质可在空气中燃烧.
(1)X的元素符号是________,其单质之一的X4分子中,X原子的杂化类型为________杂化;Y原子核外电子排布式为________.
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为________.
(3)探寻同一主族元素性质的一些共同规律,是学习化学的重要方法之一.在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式.(化学式中必须写Z的元素符号).

查看答案和解析>>
科目: 来源:江苏省南京六中2008-2009学年度高三第一学期期中考试 化学试卷 题型:022
根据图示回答下列问题:

(1)写出A、E、G的结构简式:A________,E________,G________;
(2)反应②的化学方程式(包括反应条件)是________,反应④化学方程式(包括反应条件)是________;
(3)写出①、⑤的反应类型:①________、⑤________.
查看答案和解析>>
科目: 来源:吉林省长春外国语学校2008-2009学年上学期高三期中考试(化学) 题型:022
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物.
请回答:
(1)W元素是________;Z元素是________.
(2)化合物WY和WX2的化学式分别是________和________.
(3)Y和Z形成的两种常见化合物的分子式是________和________.
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式________.
查看答案和解析>>
科目: 来源:黑龙江省大庆实验中学2008-2009学年上学期高三期中考试(化学) 题型:022
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.
这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去).
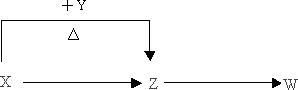
请回答:
(1)W的电子式是________.
(2)X与Y在溶液中反应的离子方程式是________.
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体.
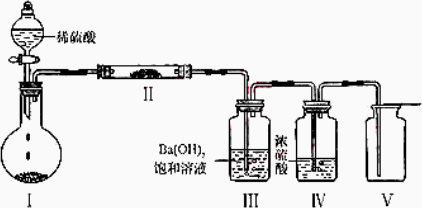
①装置Ⅰ中反应的化学方程式是________,装置Ⅱ中物质的化学式是________.
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是________,所需仪器装置是________(从上图中选择必要装置,填写编号).
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是________.
查看答案和解析>>
科目: 来源:黑龙江省大庆实验中学2008-2009学年上学期高二期中考试(化学) 题型:022
有两种含碳、氢、氧的酯A、B,其组成均为含碳54.5%,含氢9.1%,其密度(蒸气)均为3.94 g/L(标准状况),A与B能发生如下反应,经测定,其中B、E、G、H、I能与银氨溶液发生反应并在分子中不含支链.
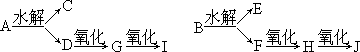
(1)写出下列结构简式和名称
B:________、________;D:________、________;J:________、________;
(2)写出H与银氨溶液发生反应的化学方程式________.
查看答案和解析>>
科目: 来源:黑龙江省大庆实验中学2008-2009学年上学期高二期中考试(化学) 题型:022
根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含铁、硫两种元素,其中金属元素的质量分数约为46.7%.
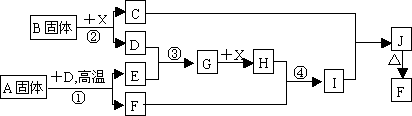
(1)G的化学式为________;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为________;
(3)反应②的离子方程式:________;
(4)反应④的离子方程式:________;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:________.
查看答案和解析>>
科目: 来源:黑龙江省大庆实验中学2008-2009学年上学期高二期中考试(化学) 题型:022
向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为________mol/L·min.
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5 mol/L·min;乙v(Y)=2 mol/L·min;丙v(Z)=4.5 mol/L·min;丁v(X)=0.075 mol/L·s.若其它条件相同,温度不同,则温度由高到低的顺序是(填序号)________
(3)若向达到(1)的平衡体系中充入氩气,则平衡向________(填"左"或"右"或"不移动");若向达到(1)的平衡体系中移走部分混合气体,则平衡向________(填"左"或"右"或"不移动").
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率(4)与(1)的平衡中的X的转化率相比较________
A.无法确定
B.(4)一定大于(1)
C.(4)一定等于(1)
D.(4)一定小于(1)
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为________
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为________
查看答案和解析>>
科目: 来源:黑龙江哈尔滨市第六中学2008-2009学年度上学期期中考试高三化学试题 题型:022
如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质.下图中部分反应产物已略去.

(1)X的化学式为________;F的电子式为________.
(2)反应①的离子方程式为________.
反应②的化学方程式为________.
(3)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16 g固体C.则滤液A中溶质的物质的量浓度为________.(假设溶液体积不变)
查看答案和解析>>
科目: 来源:河北衡水中学2008-2009学年度高三上学期期中考试(化学) 题型:022
水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:

[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-]
(1)Pb(NO3)2溶液中,![]() ________2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,![]() 增加,可能的原因是________.
增加,可能的原因是________.
(2)往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有________,pH=9时,主要反应的离子方程式为________.
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
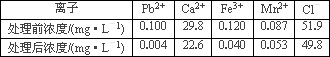
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是________.
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+![]() E2Pb(s)+2H+
E2Pb(s)+2H+
则脱铅的最合适pH范围为________(填代号).
A.4~5
B.6~7
C.9~10
D.11~12
查看答案和解析>>
科目: 来源:河北衡水中学2008-2009学年度高三上学期期中考试(化学) 题型:022
一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色.当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol/L.经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)

(1)容器中气体出现红棕色的原因(用化学方程式表示)是________;
(2)前2 s内,乙容器中以N2O4的浓度变化表示的反应速率为________;
(3)达到平衡时,甲容器中反应所需的时间________60 s(填“大于”“小于”或“等于”,以下同);两容器中都达到平衡时,N2O4的浓度甲________乙;反应过程中吸收的能量甲________乙.
(4)两容器都达到平衡后,若要使甲、乙中N2O4浓度相等,不能采取的措施是________
A.保持温度不变,适当压缩甲容器体积
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com