
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-铁铜及其化合物(1) 题型:022
铜、铁、锌等质量组成的合金W g,加入到FeCl3和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有________,还可能有________.
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有________,可能还有________.
(3)若剩余固体为![]() ,则溶液中的阳离子一定有________,一定没有________.
,则溶液中的阳离子一定有________,一定没有________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-溶解平衡与溶解度 题型:022
如图:横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题.
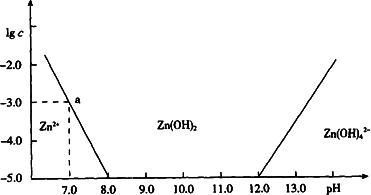
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________.
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)![]() ________.
________.
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________.
(4)往1.00 L 1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH________mol
(5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
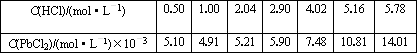
根据上表数据判断下列说法正确的是________(填字母序号)
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-镁铝及其化合物 题型:022
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料.提取氧化铝的工艺流程如下:
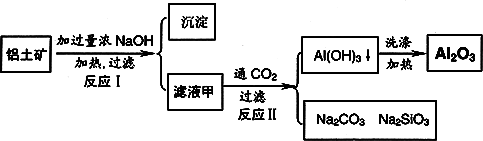
(1)滤液甲的主要成分是(写化学式)________
(2)写出反应Ⅱ的离子方程式:________
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是________(填字母序号)
a.AlO2―或[Al(OH)4]-
b.OH―
c.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失.沉淀消失的原因可用离子方程式表示为:________
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解.
①加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:________.
②请画出生成沉淀的物质的量与加入盐酸体积的关系图.
查看答案和解析>>
科目: 来源:安徽省宿州市灵璧中学2009届化学第三次月考试题 题型:022
有A、B、C、D四种单质.在一定条件下,B可以和A、C、D化合生成化合物甲、乙、丙,C和D化合生成化合物丁.已知甲、乙、丙每个分子中都含有10个电子,并且甲、乙、丙、丁有如下关系:
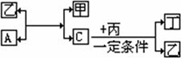
回答:(1)单质B的化学式________.
(2)单质A与化合物乙反应的化学方程式________.
(3)根据化合物丙、丁中D元素化合价判断丙、丁是否在一定条件下生成单质D,简述判断理由________.
查看答案和解析>>
科目: 来源:安徽省宿州市灵璧中学2009届化学第三次月考试题 题型:022
二氧化碳在碳的循环中站据重要的角色,回答下列问题:
(1)、分别写出二氧化碳分子的电子式及结构式________;________
(2)、二氧化碳的过量排放,严重影响人类的生存环境,处理和利用二氧化碳是全球关注的重大问题,下列哪些情况可以造成大气中二氧化碳的增加________
①绿色植物减少;
②汽车排放尾气;
③森林大火;
④工厂排放大量二氧化碳;
⑤动物、植物的呼吸;
⑥动物遗体经微生物的分解破坏.
(3)、大气中二氧化碳增加,影响植物的生长,例如水果越来越大.这提示我们:随着大气中二氧化碳含量升高,会出现________
(A)植物中的有机物含量降低
(B)植物的生长速率降低
(C)植物光合作用减弱
(D)植物光合作用增强
(4)、钟乳石和石笋的主要成分是碳酸钙.随着旅游人数的增加,潮湿溶洞中的钟乳石和石笋受到二氧化碳侵蚀,其化学方程式为:________.
查看答案和解析>>
科目: 来源:安徽省蚌埠二中2009届高三12月月考化学试题人教版 题型:022
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置.倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,c装置中溶液无变化,反应后进人量气管气体的体积为V mL(已折算成标准状况).由上述实验可知:
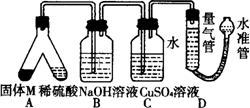
(1)①固体M中一定含有的物质是________(填化学式);
②其中一种物质的质量可以确定为________g.
(2)B装置的名称是________.写出其中反应的离子方程式________.
(3)C装置的作用是________,如果实验中没有B装置,则C装置中产生的现象是________.
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是________.
(5)通过进一步实验,测得固体M中各种成分之和小于反应前铁粉和硫粉的质量之和.产生这种现象的原因可能是________.
a.M中有未反应的铁和硫
b.测定气体体积时水准管的的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前末用浓硫酸干燥
查看答案和解析>>
科目: 来源:四川省乐山市2009届高三上学期第一次模拟考试、理科综合能力测试化学试题 题型:022
下表是短周期中部分元素的原子半径及主要化合价.
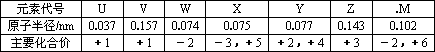
请回答:
(1)X在元素周期表中的位置是________;
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺是________(用元素符号表示);并用离子方程式表示出Z离子可作净水剂的原因________.
(3)M的单质能跟V的最高价氧化物水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式________.
(4)W、X、Y分别与U均可形成10电子共价化合物,晶体类型均为________,其中,属于非极性分子的是(写化学式)________,若将其作为燃料,以熔融的K2CO3为电解质,空气作为氧化剂,并选择适当的隋性电极,组成原电池.写出该电池工作时的负极反应式________________.
查看答案和解析>>
科目: 来源:四川省乐山市2009届高三上学期第一次模拟考试、理科综合能力测试化学试题 题型:022
将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体.这四种物质与其他的相互转化关系如下图所示,C是一种非极性分子.图中部分反应条件及生成物没有列出.请按要求填空:
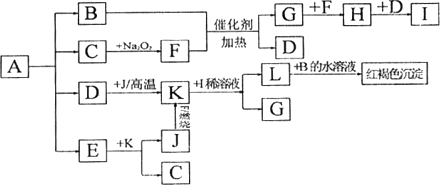
(1)单质J的化学式________,E的分子式是________;
(2)写出B和F反应的化学方程式________,D和Na2O2反应的化学方程式________;
(3)写出K与I的稀溶液反应的离子方程式________________.
(4)A的化学式为________________.
查看答案和解析>>
科目: 来源:上海市凤城高中2009届高三寒假模拟考试、化学试题 题型:022
如图所示,当关闭K时,向A中充入2 mol X、7 mol Y,向B中充入4 mol X、14 mol Y,起始时VA=VB=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:
2X(g)+2Y(g)![]() Z(g)+2W(g)ΔH<0,达到平衡Ⅰ时VB=0.9a升,试回答:
Z(g)+2W(g)ΔH<0,达到平衡Ⅰ时VB=0.9a升,试回答:
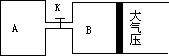
(1)A中W和B中Z的物质的量的比较:n(W)A________n(Z)B(填<、>、或=)
(2)B中X的转化率α(X)B多少?
(3)打开K,过一段时间重新达平衡Ⅱ时,B的体积为多少升?(用含a的代数式表示,连通管中气体体积不计)[写出(2)、(3)的计算过程]
查看答案和解析>>
科目: 来源:上海市凤城高中2009届高三寒假模拟考试、化学试题 题型:022
现有下列物质:
①Cl2 ②SO2 ③0.1 mol·L-1 Na2CO3 ④0.1 mol·L-1 NH3H2O ⑤0.1 mol·L-1 CH3COOH ⑥BaSO4
(1)属于强电解质________属于弱电解质________属于非电解质________,向⑤中加入等物质的量④,溶液导电性________(填“增强”或“减弱”)
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程.________________.
(3)同学乙认为③溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%.请你设计实验证明该同学的观点是否正确.________________.
(4)在T℃时,反应2SO2(g)+O2(g) 2SO3(g)ΔH<0的平衡常数K=6×102则:
①温度升高,化学平衡移动后,平衡常数K值________(填“增大”、“减少”或“不变”).
②T℃时,某生向容积为2 L的密闭容器中充入0.4 mol SO2、0.18 mol O2和1.2 mol SO3的混合气体,此时该反应是否处于化学平衡状态________(填“是”或“否”),化学反应速率V(正)________V(逆)(填“大于”、“等于”或“小于”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com