
科目: 来源:2008年宁夏中卫一中高三第三次模拟考试、理科综合能力测试化学部分 题型:022
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)![]() 3NH3(g) ΔH=-92.2 kJ·mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:
3NH3(g) ΔH=-92.2 kJ·mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:
催化剂:铁触媒,温度400℃~500℃,压强:30 MPa~50 MPa.
回答下列问题:
(1)合成氨工业中原料气压缩到30 MPa~50 MPa的原因是________;从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400℃~500℃的高温,原因是________.
(2)500℃、50 MPa时,在容积为1 L的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x.则K和x的关系满足K=________.
(3)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2.已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
又知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量.写出CH4和H2O在高温下反应的热化学方程式________________.
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池.请写出该电池的正极反应式________.
查看答案和解析>>
科目: 来源:2008年宁夏中卫一中高三第三次模拟考试、理科综合能力测试化学部分 题型:022
二氧化硫、二氧化氮是大气的污染物.为消除NO2对大气的污染可通过反应:
□NO2+□NH31.(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中氧化产物与还原产物的物质的量之比为________
2.已知2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
(3)该反应的平衡常数表达式为K=________;
(4)已知上述反应为放热反应,则其反应热D H________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值________(填“增大”、“减小”或“不变”);
(5)若使SO3浓度增大,则上述平衡向________反应方向移动(填“正”或“逆”);
(6)若已知在2 L的密闭容器中2 min内消耗O2为8 moL,则SO3的生成速率为v(SO3)=________mol/(L·min).
查看答案和解析>>
科目: 来源:2008年宁夏中卫一中高三第三次模拟考试、理科综合能力测试化学部分 题型:022
如下图所示:A、B试管中装满NaOH溶液,X、Y为惰性电极,a、b为电池的两极,关闭K2断开K1后A、B试管中的现象如图中所示.回答下列问题:
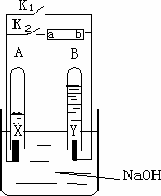
①.关闭K2断开K1后Y的电极反应为________,X电极的名称为________.NaOH溶液的PH变________(填大、小或不变)
②.断开K2关闭K1后Y电极名称为________X的电极反应为________
查看答案和解析>>
科目: 来源:2008年宁夏银川一中高三年级第三次模拟考试、理科综合试卷化学部分 题型:022
请根据下图回答:
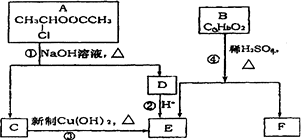
已知:一个碳原子上连有两个羟基时,易发生下列转化:
(1)E中含有的官能团的名称是________.
(2)反应③的化学方程式是___________.
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2)∶n(H2O)=2∶1,则B的分子式为________.
查看答案和解析>>
科目: 来源:2008年宁夏银川一中高三年级第三次模拟考试、理科综合试卷化学部分 题型:022
W、X、Y、Z、N是短周期元素,它们的核电核数依次增大.下表列出它们的性质和结构:

(1)W元素单质的结构式:___________.
(2)Y元素原子的电子排布式为________.
(3)Y、Z和N三种元素第一电离能由大到小的顺序为________(填元素符号).
(4)Y、X和Z三种元素形成的单质熔点由高到底的顺序为________(填单质的化学式).
(5)Z和X形成的化合物构成的晶体属于________晶体;Y和N形成的化合物构成的晶体中每个Y离子周围等距离最近的N离子构成的空间结构为________.
查看答案和解析>>
科目: 来源:2008年宁夏银川一中高三年级第三次模拟考试、理科综合试卷化学部分 题型:022
水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C(s)+H2O(g)![]() CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.
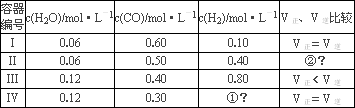
请根据上表数据计算出该温度下该反应的平衡常数的数值________
填写表中相应的空格①________、②________;
(2)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0 mol炭和1.0 mol水蒸气,发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍,平衡时水蒸气的转化率为________;向该容器中补充a mol炭,水蒸气的转化率将________(填“增大”、“减小”、“不变”).
(3)己知:CO(g)+![]() O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
C(s)+![]() O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
那么,将12 g炭完全转化为水煤气,然后再燃烧,整个过程放出________kJ的热量.
查看答案和解析>>
科目: 来源:2008年宁夏银川一中高三年级第三次模拟考试、理科综合试卷化学部分 题型:022
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子且互不重复)
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B的溶液中水的电离程度相同;D溶液焰色反应显黄色.
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象.
(1)A的名称是________
(2)写出C溶液和D溶液反应的化学方程式________
(3)25℃时pH=9的A溶液和pH=9的C溶液中水的电离程度小的是________(填的A或C化学式);
(4)25℃时用惰性电极电解D的水溶液,一段时间后溶液的pH________7;(填>、<或=)
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为________;
(6)室温时在一定体积0.2 mol·L-1的C溶液中,加入一定体积的0.1 mol·L-1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是________.
查看答案和解析>>
科目: 来源:2008届宁夏银川一中高三年级第一次模拟考试、理科综合能力测试化学部分 题型:022
设X、Y、Z代表3种短周期元素,已知:
①Ym-和Zn-两种离子具有相同的电子层结构;
②Y与X可以形成原子个数比为1∶1的化合物甲和1∶2的化合物乙(常温下甲、乙为液态),甲和乙都是共价化合物;
③Z与X形成原子个数比为1∶1的化合物丙,其分子与乙的分子所含质子数相同.填写下面空白:
(1)Y元素的原子结构示意图:________,Z元素的原子核外电子排布式________.
(2)化合物甲是由________键组成的________分子(填“极性”或“非极性”).化合物乙的空间结构是:________.
(3)Z单质与化合物乙发生反应的基本类型是________.(填四种基本化学反应类型)
(4)化合物丙与氢氧化钠溶液反应的离子方程式是________.
查看答案和解析>>
科目: 来源:2008届宁夏银川一中高三年级第一次模拟考试、理科综合能力测试化学部分 题型:022
在一个固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
A(g)+2B(g)已知加入1 mol A和3 mol B,5分钟后达到平衡,生成了a mol C
(1)从开始到平衡用A表示该反应的平均反应速率________mol/(L·min)(用含a的表达式表示,下同).达到平衡时,C在反应混合气中体积分数是________
(2)在相同实验条件下,若在同一容器中改为2 mol A和6 mol B,达到平衡后,C的物质的量为________mol此时C在反应混合气体中的物质的量浓度________(填“增大”“减小”或“不变”).
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数不变,则还应加入C________mol.
查看答案和解析>>
科目: 来源:2008届宁夏银川一中高三年级第一次模拟考试、理科综合能力测试化学部分 题型:022
下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物或反应物、反应条件均已略去.已知:A是一种常见固体单质;B、X都是气体,分属短周期中不同周期元素的单质;D是双原子分子,一个D分子中含有18个电子;化合物Y进行焰色反应时呈黄色.

(1)写出D的化学式________;Y的电子式________.
(2)A、B、X必定是由金属元素组成的为________;
(3)据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%-20%.A发生腐蚀的主要原因是(填写下面的选项序号)________;
a.化学腐蚀
b.电化学腐蚀
c.其它原因而腐蚀
(4)检验E中阳离子的实验方法有多种,请选择一种方法,你所选的试剂是________对应的现象是________.
(5)写出沉淀J转化为沉淀H的化学反应方程式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com