
科目: 来源:2009届上海市南汇中学高三年级零次月考、化学试卷 题型:022
充分燃烧只含碳、氢、氧的某有机物1 mol,消耗的氧气与产生的CO2的物质的量分别为91 mol和81 mol.若该有机物的分子量为136,分子中只有一个侧链,它能与NaOH溶液反应,但不与Na2CO3溶液反应,也不能使FeCl3溶液变色.试计算
(1)该有机物的分子式________
(2)该有机物可能的结构简式________
查看答案和解析>>
科目: 来源:2009届上海市南汇中学高三年级零次月考、化学试卷 题型:022
近年来,全世界石油价格居高不下,其主要原因是随着社会生产的发展,人口地曾多,对能源的需求量逐年增加,全不堪石油含量下降.寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法.
已知:
(1)凡与醛基直接相连的碳原子上氢称为α-H原子,在稀碱溶液的催化作用下,一个醛分子的α-H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
R-CH2-CHO+R1-CH2-CHO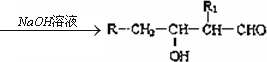
(2)2R-CH2-Cl+2Na![]() R-CH2-CH2-R+2NaCl
R-CH2-CH2-R+2NaCl
CH3-CH=CH2+H-Cl![]()
(3)合成线路如下:
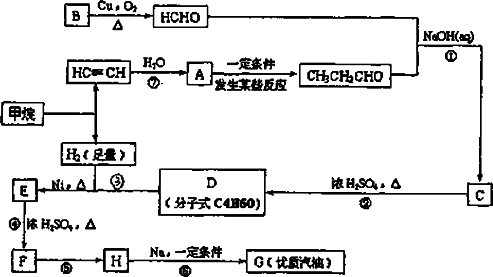
(1)写出D的结构简式________.
(2)在反应②-⑦中,属于加成反应的是________,属于消去反应的是________.
(3)写出下列反应方程式E-F________.
H-G________.
(4)H也能与NaOH水溶液反应,其方程式为________.
生成的有机能否在Cu或Ag作催化剂的条件下被空气氧化________(填“能”或“否”.)
查看答案和解析>>
科目: 来源:2009届上海市南汇中学高三年级零次月考、化学试卷 题型:022
某有机物A的相对分子质量为94.5,在一定条件下可发生如下转化(其他产物和水已省略),请回答下列问题:
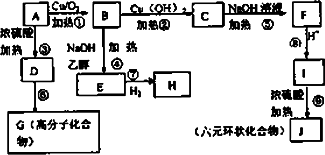
(1)按要求写化学式:A的分子式________J的结构简式________.
(2)在上述的①-⑨反应中,属于取代反应的是________,属于消去反应的是_________________.
(3)写出下列反应的化学方程式:B-C________C-F________.
(4)有机物I可合成一种环保型的高分子材料,则高分子材料的结构简式为_________________.
(5)写出I的一种同分异构体(与Na、NaOH的银氨溶液均能反应)的结构简式_________________.
查看答案和解析>>
科目: 来源:2009届山东诸城一中高三年级阶段性评估练习、化学试题 题型:022
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)
试回答:
(1)若X是强氧化性单质,则A不可能是________.
a.S
b.N2
c.Na
d.Mg
e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀.则B的化学式为________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)________.
检验此C溶液中金属元素价态的操作方法是________
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为________,或________.
查看答案和解析>>
科目: 来源:2009届山东诸城一中高三年级阶段性评估练习、化学试题 题型:022
物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化.若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性.则
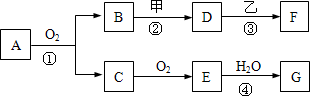
(1)①反应的化学方程式是________.
(2)②③两步反应的离子方程式分别是________,________.
(3)在④的反应中,每1 mol E参加反应,将会有________mol电子发生转移.
查看答案和解析>>
科目: 来源:2009届山东师范大学附属中学高三年级第二次月考、化学试卷 题型:022
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
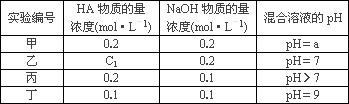
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,
若a________7(填>、<或=),则HA为强酸;
若a________7(填>、<或=),则HA为弱酸.
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________.
A.前者大
B.后者大
C.二者相等
D.无法判断
(3)从丙组实验结果分析,HA是________酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1.
查看答案和解析>>
科目: 来源:2009届山东省实验中学高三第二次诊断性测试、化学试卷 题型:022
在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)![]() 3C(g)+D(s),反应达到平衡时C的浓度为1.2 mol/L.
3C(g)+D(s),反应达到平衡时C的浓度为1.2 mol/L.
(1)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是________(用序号填空)
①4 mol A+2 mol B
②3 mol C+1 mol D+1 mol B
③3 mol C+2 mol D
④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mol D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于________L,小于________L.
查看答案和解析>>
科目: 来源:2009届三亚市一中高三年级第二次月考、化学试卷 题型:022
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27% O211% N2 82%);

(1)已各SO2的氧化是放热反应,如何利用表中数据推断此结论?
___________________;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
___________________;
(3)选择适宜的催化剂,是否可以提高SO2的转化率?________(填“是”或“否”),是否可以增大该反应所放出的热量?________(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用________吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);ΔH=-196.9 kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量.
查看答案和解析>>
科目: 来源:2009届三亚市一中高三年级第二次月考、化学试卷 题型:022
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)Ge的原子核外电子排布式为________
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是________
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式________;
②SiO2晶体的空间构型及硅氧之间的成键方式________;
③已知SnO2是离子晶体,写出其主要物理性质________(写出2条即可)
(4)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为________
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060 cm-1,CO分子中碳氧键的伸缩振动频率为2143 cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度________(填字母)
A.强
B.弱
C.相等
D.无法判断
查看答案和解析>>
科目: 来源:2009届三亚市一中高三年级第二次月考、化学试卷 题型:022
1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献.Grignard试剂的合成方法是:RX+Mg![]() RMgX(Grignard试剂).生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂).生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有一定对称性.合成线路如下:
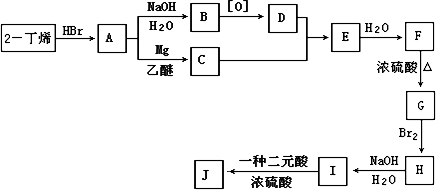
请按要求填空:
(1)3,4-二甲基-3-己醇是:________(填代号),E的结构简式是________;
(2)C→E的反应类型是________,F→G的反应类型是________;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B_______________,
I→J_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com