
科目: 来源:福建省泉州市德化县2010届高三上学期期末考试化学试卷 题型:022
以黄铁矿为原料生产硫酸的工艺流程图如下:
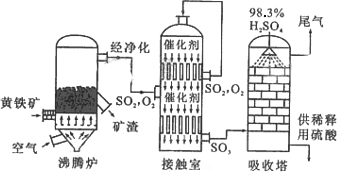
(1)请写出沸腾炉中黄铁矿燃烧的化学方程式:________________.
(2)接触室中2SO2(g)
+O2(g)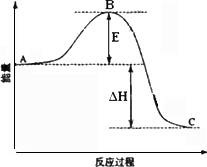
①依据工艺流程图判断下列说法正确的是(选填序号字母)________.
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
②反应达到平衡时,平衡常数表达式K=________,升高温度,K值________(填“增大”、“减小”或“不变”);图中△H=________KJ·mol-1.
③图中C点表示________,E的大小对该反应的反应热________(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点________(填“升高”或“降低”).
④如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=________mol·L-1·min-1;
⑤已知单质硫的燃烧热为-296 KJ·mol-1,计算由S(s)生成3 mol SO3(g)的△H=________.
(3)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是________________.
查看答案和解析>>
科目: 来源:福建省泉州市德化县2010届高三上学期期末考试化学试卷 题型:022
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试、化学(天津卷) 题型:022
奶油中有一种只含C、H、O的化合物A.A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2∶4∶1.
(1)A的分子式为________.
(2)写出与A分子式相同的所有酯的结构简式:________________________________________.
已知:
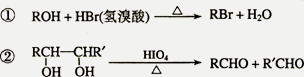
A中含有碳氧双键,与A相关的反应如下:
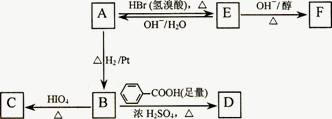
(3)写出A→E、E→F的反应类型:A→E________、E→F________.
(4)写出A、C、F的结构简式:A________________、C________________、F________________.
(5)写出B→D反应的化学方程式:________________________________.
(6)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:________________________.A→G的反应类型为________.
查看答案和解析>>
科目: 来源:广东英德中学2010届第一次月考理科综合化学试题 题型:022
某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:________(填序号).
A.盐酸
B.浓硫酸
C.稀硫酸
D.醋酸.
(2)该反应中发生还原反应的过程是:________→________.
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:
_______________________.
(4)如果上述反应中有6.72 L(标准状况.)气体生成,转移的电子数为________mol.
(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为________,并阐明H2O2被称为绿色氧化剂的理由是_____________________.
查看答案和解析>>
科目: 来源:河北省正定中学2010届高三上学期第一次月考化学 题型:022
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:
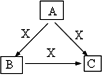
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在.则,A中含有的金属元素的名称为________.
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构.
①B的电子式为________.
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为:_______________.
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
①A中所含有的化学键是________、________.
②将4.48 L(标准状况下)X通入100 mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为________.
查看答案和解析>>
科目: 来源:河北省正定中学2010届高三上学期第一次月考化学 题型:022
某待测溶液中可能含有Na+、SO42-、SO32-、CO32-、Cl-、NO3-、HCO3-等离子,进行了下述实验.(所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量)
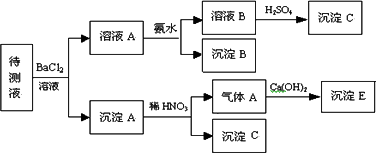
(1)判断待测液中有无SO42-、SO32-,并说明理由:________;
(2)写出沉淀B的化学式:________;
(3)沉淀C可能是什么物质:________;
(4)写出产生沉淀B的离子方程式:________.
查看答案和解析>>
科目: 来源:山西省太原市五中2009届高三第二学期2月月考化学试题 题型:022
某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为1.96 g的该结晶水合物,分别制成溶液.一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变成灰绿色,最后变为红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g.另一份加入含0.001 mol KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+.请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是________和________,阴离子是________.
(2)试通过计算确定该结晶水合物的化学式.
查看答案和解析>>
科目: 来源:山西省太原市五中2009届高三第二学期2月月考化学试题 题型:022
已知A~K所代表的各物质都是中学化学里常见的物质,且I是具有磁性的物质,D和K都具有两性.一定条件下,各物质间的相互反应转化关系如下图所示:
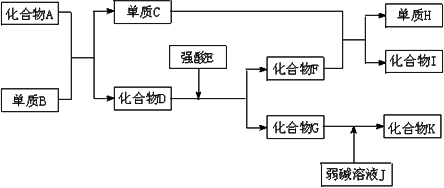
请回答:
(1)写出有关物质化学式:D是________,H是________.
(2)写出下列反应的方程式:
①化合物G的溶液不呈中性,其原因可用离子方程式________表示,
②C+F→H+I________.
查看答案和解析>>
科目: 来源:山西省太原市五中2009届高三第二学期2月月考化学试题 题型:022
合成氨对工.农业生产和国防都有重要意义.
已知:N2(g)+H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol请回答:
2NH3(g);ΔH=-92.4 kJ/mol请回答:
(1)合成氨对工业中采取的下列措施可以用勒夏特列原理解释的是________(填字母).
a.用铁触媒加快化学反应速率
b.采用较高压强(20M Pa-50M Pa)
c.将原料气中的少量CO等气体净化出来
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应.
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N2的转化率α1=________,此时反应放出的热量________kJ;
②若容器压强恒定,则达到平衡时,容器中N2的转化率=α2________α1(填“<”“>”或“=”)
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压.570℃条件下高转化率的电解法合成氨(装置如图).钯电极A是电解池的________极(填“阳”或“阴”),该极上的电极反应式是________.
查看答案和解析>>
科目: 来源:山西省太原市五中2009届高三第二学期2月月考化学试题 题型:022
X、Y、Z、W均为短周期非金属主族元素,原子序数依次增大.Z的质子数等于X、Y质子数之和;W与Z最外层电子数相同,且W的电子总数是Z的电子总数的二倍,.
(1)Y单质的结构式:________其氢化物的空间结构呈________形.
(2)X、Z元素可组成原子个数比为1∶1的化合物甲,其电子式为________Z、W元素可组成质量比为1∶1的化合物乙,甲与乙反应生成一种常见强酸丙,化学方程式为:________;用惰性电极电解丙溶液的阳极反应式________.
(3)Y的氢化物与化合物乙有许多性质相似.结合下图回答:如何通过它们溶于水时的现象不同来鉴别它们:______________________________.

(4)由X、Y、Z、W四种元素可组成多种离子化合物,其中有一种,溶于水时完全电离产生三种离子,且溶液呈酸性,0.1 mol/L该盐溶液中,离子浓度由小到大的顺序是:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com