
科目: 来源:安徽省淮北市第一中学2010届高三上学期第三次月考化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:湖南省岳阳市一中2010届高三第四次月考、化学试卷 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:湖南省岳阳市一中2010届高三第四次月考、化学试卷 题型:022
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:湖南省岳阳市一中2010届高三第四次月考、化学试卷 题型:022
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)下图是N2和H2反应生成2 mol NH3过程中能量变化示意图,请计算每生成1 mol NH3放出热量为________.

(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与t的关系如下表:
2NH3(g),其化学平衡常数K与t的关系如下表:
请完成下列问题:
①试比较K1、K2的大小,K1________K2(填写“>”“=”或“<”)
![]()
②下列各项能作为判断该反应达到化学平衡状态的依据的是________(填序号字母).
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式________.
②盐酸肼水溶液中离子浓度的关系表示正确的是________(填序号).
A
.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)B.c(Cl-)>c([N2H5·H2O]+)>c(OH-)>c(H+)
C.2c(N2H62+)+c([N2H5·H2O]+)+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源:湖南省岳阳市一中2010届高三第四次月考、化学试卷 题型:022
在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g)![]() 2C(g)达到平衡时,保持容器内气体的总物质的量为12 mol.现向反应容器中加入6.5 molA,x molB,2.0 molC.
2C(g)达到平衡时,保持容器内气体的总物质的量为12 mol.现向反应容器中加入6.5 molA,x molB,2.0 molC.
(1)若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是________热反应.
(2)欲使反应维持向逆反应方向移动,则x的取值范围为________.
(3)在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12 mol),按D(g)+E(g)![]() 2F(g)发生反应.当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%.若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为________(用m、n表示;设A、B、C和D、E、F之间均不发生反应).
2F(g)发生反应.当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%.若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为________(用m、n表示;设A、B、C和D、E、F之间均不发生反应).
查看答案和解析>>
科目: 来源:湖南省师大附中2010届高三第四次月考、化学试卷 题型:022
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K=________.
(2)前2s内的平均反应速率v(N2)=________.
(3)在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”、“<”、“=”).
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________.
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
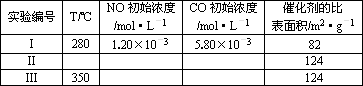
①请在上表格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线示意图,并标明各条曲线的实验编号.

查看答案和解析>>
科目: 来源:湖南省师大附中2010届高三第四次月考、化学试卷 题型:022
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
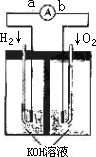
(1)氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向为________(用a、b表示).
(2)正极反应式为________.
(3)电极表面镀铂粉的原因为________.
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________.
②已知LiH固体密度为0.82 g/cm3.用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________.
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol.
查看答案和解析>>
科目: 来源:湖南省师大附中2010届高三第四次月考、化学试卷 题型:022
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.
已知:
①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.
请回答:
(1)Z2Y的电子式是________.
(2)Z2Y2与X2Y反应的化学方程式是________.
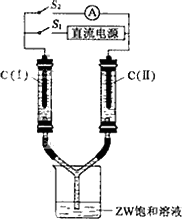
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.此时:C(Ⅰ)的电极名称是________(填写正极或负极);其电极反应式是________.
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是________.
查看答案和解析>>
科目: 来源:湖南省浏阳一中2010届高三第四次月考、化学试卷 题型:022
某芳香化合物
H常用作食用香精.用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5∶5∶1.H只有一个支链;它能与溴的四氯化碳溶液发生加成反应.且在碱性条件下能发生水解反应,产物之一是甲醇.G是H的同分异构体.用芳香烃A为原料合成G的路线如下:
(1)G的分子式是________
(2)化合物c的官能团名称是________,反应②、⑤的反应类型分别是________、________.
(3)预测E分子中苯环侧链核磁共振氢谱峰面积(由小到大)之比为________.
(4)写出反应①、⑥的化学方程式:
①________;
⑥________.
(5)H的结构简式是________.
查看答案和解析>>
科目: 来源:湖南省浏阳一中2010届高三第四次月考、化学试卷 题型:022
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
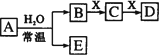
①:若A是单质,B和D的反应是OH-+HCO![]() =H2O+CO
=H2O+CO![]() ,则E与Fe2O3的反应方程式为________
,则E与Fe2O3的反应方程式为________
②:若D为CO,B与D反应生成C,C能和E反应,则A的电子式为:________
③:若D为白色胶状沉淀,与A摩尔质量相等,则X中一定含________(填元素符号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com