
科目: 来源:上海市吴淞中学2011届高三上学期第二次月考化学试题 题型:022
1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献.Grignard试剂的合成方法是:
RX+Mg![]() RMgX(Grignard试剂)
RMgX(Grignard试剂)
生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种.
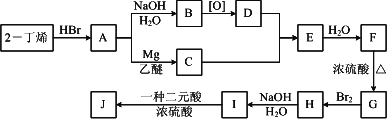
请按要求填空:
(1)结构简式:F________;J________.
(2)C+D→E的反应类型是________,F→G的反应类型是________.
(3)写出下列化学反应方程式(有机物请用结构简式表示):
2-丁烯→A:________;
A→B:________;
B→D:________;
查看答案和解析>>
科目: 来源:上海市吴淞中学2011届高三上学期第二次月考化学试题 题型:022
下表是由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处.请用相应的化学用语回答下列问题:
(1)e元素原子结构示意图为________;e与g可以形成1∶1型化合物,该化合物电子式为________,它属于________化合物(填“离子”、“共价”).
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式________.
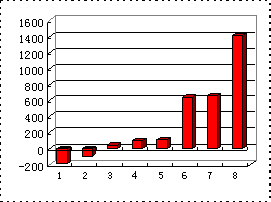
(3)下图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表________(填化学式),判断理由是________.
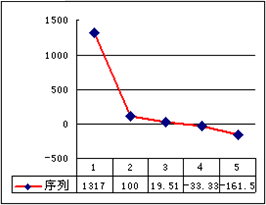
(4)b、c、d、e、f所对应的最简单氢化物的沸点(℃)直角坐标图(下图),序列“5”的氢化物的名称是________,已知c元素最简单的氢化物8 g在空气中完全燃烧生成液态水时,放出445.15 kJ热量,该反应的热化学方程式为:________.
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期中考试化学试题 题型:022
分子式为C12H14O2的F有机物广泛用于香精的调香剂.
已知:①R-CH2X+NaOH![]() R-CH2OH+NaX(X代表卤素原子)
R-CH2OH+NaX(X代表卤素原子)
②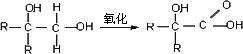
为了合成该物,某实验室的科技人员设计了下列合成路线:
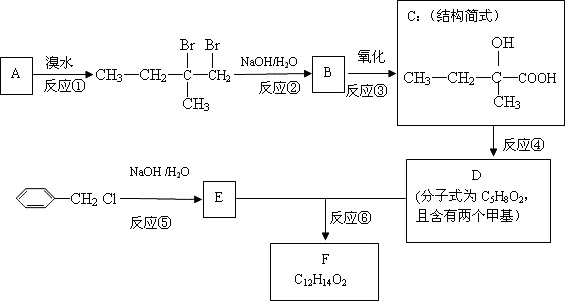
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现________种峰;C物质的官能团名称________;E物质的结构简式________;
(2)上述合成路线中属于取代反应的是________(填编号);
(3)反应④的化学方程为________;
(4)写出E属于芳香族化合物所有的同分异构体________.
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期中考试化学试题 题型:022
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素.请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是________和________,相同条件下两者在水中的溶解度较大的是________(写分子式),理由是________;
(2)Q的元素符号是________,它的核外电子排布式为________,在形成化合物时它的最高化合价为________;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键________.
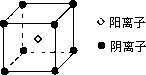
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,其电子式为________;其晶体的最小结构单元如图所示,经实验测得FH5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为________cm.
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期中考试化学试题 题型:022
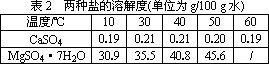
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质
(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
硼镁泥制取七水硫酸镁的工艺流程如下:
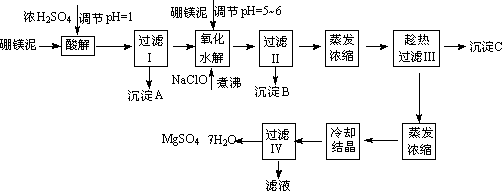
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤Ⅰ的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为________.加热煮沸的主要目的是________.
(2)沉淀B中除MnO2、SiO2外还含有________(填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是________;
(4)沉淀C的化学式是________.过滤Ⅲ需趁热过滤的理由是________
.查看答案和解析>>
科目: 来源:新疆乌鲁木齐2011届高三第三次月考化学试题 题型:022
A.B.C.D.E为含同一种元素的常见物质.C物质只由一种元素组成,在1个C分子中形成共价键的电子数与分子中所含电子数之比为3∶7.C和E均可与氧气在一定条件下反应生成A.请回答以下问题:
(1)常温下将气体B通入水中发生反应,生成A和D,则该反应的离子方程式________.
(2)写出E与氧气反应生成A的化学方程式________.
(3)D和E生成的化合物在某温度下加热分解,同时生成两种氧化物.且在此过程中,若有0.5 mol该化合物完全反应,转移电子数为2 mol.写出该反应的化学方程式________.
(4)下图所示是进行木炭与D浓溶液反应,并检验生成的气体和反应的热效应的实验装置,它具有无污染.现象明显等特点.具支试管A中所盛固体下层是无水CaCl2(作载体不参加反应),上层是红热的木炭.实验时慢慢将D浓溶液滴到木炭上,反应即开始进行且能长时间剧烈反应.
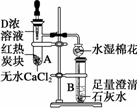
①写出木炭与D浓溶液反应的化学方程式________.
②该反应为________(填“吸热”或“放热”)反应.
③试管B内出现的现象为________.
④在实验临近结束时,发现滴管中的D浓溶液难以滴下.若想再滴入几滴D浓溶液使木炭反应完全,最简单的办法是________.
查看答案和解析>>
科目: 来源:上海市十三校2011届高三12月联考化学试题 题型:022
某植物的发酵液中含有A、B、C、D,相互关系如下:

已知:A的组成为C:40%、H:6.7%、O:53.3%,450 mgA与25 ml 0.2 mol/L,的NaOH溶液完全反应,A中含有一个-COOH和一个-CH3,它可以与乙酸发生酯化反应,C在稀硫酸或稀氢氧化钠溶液中均能反应.完成下列填空:
(1)A化学式为________,A的结构简式________;
(2)写出反应类型反应①________、反应③________;
(3)写出化学反应方程式:反应②________;由A合成高聚物的反应________;
(4)写出两种与A不完全相同官能团的同分异构体的结构简式________、________.
(5)写出由E制备B的化学反应方程式:(已知R-CH=CH2![]() R-CH/CH2CH2Br)
R-CH/CH2CH2Br)
查看答案和解析>>
科目: 来源:上海市十三校2011届高三12月联考化学试题 题型:022
活性ZnO在橡胶、塑料、涂料工业有重要应用,由粗ZnO(含FeO、CuO)制备活性ZnO流程如下:(已知:活性ZnO可用焙烧碱式碳酸锌制得)
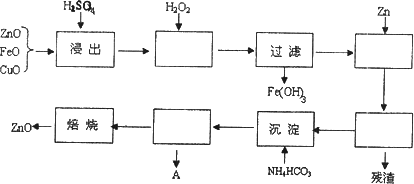
(1)上述流程中,浸出用的是60%H2SO4(1.5 g/cm3),配制这种H2SO4 100 ml需要98%H2SO4________g(保留两位小数).
(2)加H2O2的目的是________;
(3)除去Fe(OH)3后,滤液中加入Zn,这一步操作的目的是________;
(4)整个流程一共有________次过滤;
(5)流程A中主要含有的溶质是________,检验该溶质阴离子的方法是________;
(6)取碱式碳酸锌6.82 g,溶于HCl生成CO2 448 ml,溶解过程消耗HCl 0.12 mol,若该碱式盐中氢元素的质量分数为0.0176,试推测该碱式碳酸锌的化学式________.
查看答案和解析>>
科目: 来源:山东省实验中学2011届高三第二次诊断性测试化学试题 题型:022
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称)________,以下三种说法中,可以验证该结论的是(填写编号)________;
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为________.
(3)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2 L O2,消耗该化合物的质量为________.
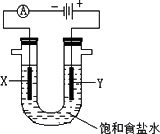
(4)B2A4是一种可燃性液体,B2A4-空气燃料电池是一种碱性燃料电池,B2A4的氧化产物为B2.用该燃料电池电解足量的饱和食盐水,如下图所示,电解装置内发生反应的离子方程式为________;检验Y极产物的方法是________;每生成0.1 mol该产物,燃料电池中消耗B2A4的物质的量为________.
查看答案和解析>>
科目: 来源:宁夏银川二中2011届高三第三次月考化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com