
科目: 来源:浙江省宁波市2011届高三上学期期末试题化学试题 题型:022
对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行
综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题.
(1)关于反应物之间的定量关系的研究:
已知反应:Br2+2Fe2+![]() 2Br-+2Fe3+,向10 mL 0.1 mol·L–1的FeBr2溶液中通入0.001 mol Cl2,该反应的离子方程式为:________
2Br-+2Fe3+,向10 mL 0.1 mol·L–1的FeBr2溶液中通入0.001 mol Cl2,该反应的离子方程式为:________
(2)关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×1012,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)=________.
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气,发生反应:
2H2O(g)![]() 2H2(g)+O2(g);ΔH=+484 kJ·mol-1
2H2(g)+O2(g);ΔH=+484 kJ·mol-1
不同时段产生O2的量见下表:
![]()
则前20 min的反应速率v(H2O)=________;
达平衡时,至少需要吸收的光能为________kJ.
③向某密闭容器中加入0.3 molA、0.1 molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示.附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同.已知,t3-t4阶段为使用催化剂[已知t0-t1阶段c(B)未画出].请回答:
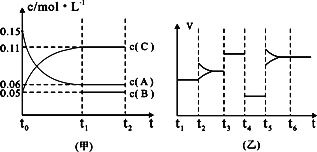
Ⅰ:t4-t5阶段改变的条件为________,
Ⅱ:B的起始物质的量为________.
查看答案和解析>>
科目: 来源:福建省福州市2011届高三上学期期末质量检查化学试题 题型:022
锂离子电池的广泛应用使回收利用锂资源成为重要课题.某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4和碳粉涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
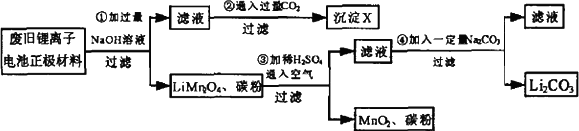
(1)第①步反应可能产生气体的化学式是________;第②步反应得到的沉淀X的化学式为________.
(2)第③步反应有锂离子(Li+)生成,其反应的离子方程式是________.
(3)四步实验都包含过滤,实验室中过滤实验要使用的玻璃仪器包括________.
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0 mL 3.0 mol·L-1的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________g Na2CO3参加了反应.
查看答案和解析>>
科目: 来源:福建省福州市2011届高三上学期期末质量检查化学试题 题型:022
V、W、X、Y、Z是原子序数依次递减的五种常见元素.X元素是地壳中含量最多的元素,Y、Z组成气态化合物M的水溶液呈碱性,W的单质在X2中燃烧的产物可使品红溶液褪色,V是一种历史悠久,应用广泛的金属元素.请回答:
(1)Y元素在周期表中的位置是________;写出X、Z两种元素组成的化合物一种用途:________.
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且属于氧化还原反应,请写出该反应的化学方程式________.
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐.该盐的水溶液的pH________7(填“大于”、“小于”或“等于”).
(4)若将V金属投入到盐酸溶液中,生成了浅绿色溶液N.N的酸性溶液与双氧水反应的离子方程式:________.
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl-4NHCl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式________;放电时溶液中H+移向________(填“正”或“负”)极.
(6)W(a)+O2(g)![]() WO2(g);ΔH1:W(g)+O2(g)
WO2(g);ΔH1:W(g)+O2(g)![]() WO2(g);ΔH2
WO2(g);ΔH2
则ΔHl________(填“>”或“(”或“=”)ΔH2.
查看答案和解析>>
科目: 来源:江苏省苏北四市2011届高三第二次调研考试化学试题 题型:022
紫草宁具有多种生物活性,能抗菌、消炎、抗肿瘤等.合成紫草宁的部分工艺流程如下:
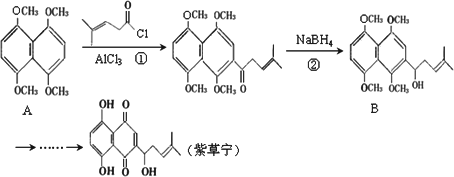
(1)紫草宁中的含氧官能团的名称是________,它含有________个手性碳原子.
(2)反应①、②的反应类型分别是________、________.
(3)A中含有萘环结构,M与A互为同分异构体,且符合下列条件:(a)M也含有萘环结构,且环上的一氯取代物只有一种;(b)1 mol M能与足量的金属钠反应生成2 mol H2;(c)M不能与Na2CO3溶液反应.
则M可能的结构简式为________(任写一种).
(4)B能发生消去反应,该反应的化学方程式为________.
(5)结合题给信息,写出由苯、乙酰氯(结构简式如图)制备聚苯乙烯的合成路线流程图(无机试剂任选).

合成路线流程图示例如下:
![]()
查看答案和解析>>
科目: 来源:江苏省苏北四市2011届高三第二次调研考试化学试题 题型:022
稀土元素是周期表中ⅢB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:

已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:

②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为________.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、________(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液
b.氨水
c.CO2气
d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:________.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在________的范围内;检验Fe3+是否沉淀完全的操作方法是________.
查看答案和解析>>
科目: 来源:海南省嘉积中学2011届高三质量检测(四)化学试题 题型:022
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
![]()
(1)上述正向反应是:________反应(填“放热”或“吸热”)
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填A、B、C、D、E).

试回答下列问题
(3)已知在一定温度下,C(s)+CO2(g)![]() 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g)![]() CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K2
H2(g)+CO2(g)平衡常数K2
则K、K1、K2之间的关系是:________.
(4)若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为:________.
(5)若反应在800℃进行,设起始时CO和H2O(g)共为5 mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=________.
(6)在VL密闭容器中通入10 mol CO和10 mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2842 kJ(已知CO燃烧为283 kJ/mol,H2燃烧热为286/kJmol),则T℃平衡常数K=________.
查看答案和解析>>
科目: 来源:海南省嘉积中学2011届高三质量检测(四)化学试题 题型:022
A、B、C、D、E、F均为常见的短周期元素,原子序数依次增大,已知:
①A元素中的一种原子没有中子.
②B元素原子最外层电子数是次外层电子数的2倍.
③C元素最高正价与最低负价的代数和为2.
④A与D能以原子个数比1∶1、2∶1形成两种液态化合物.
⑤E2+离子的电子层结构与氖原子相同.
⑥F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素的化合物.
⑦C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为________,F简单阴离子的结构示意图________,化合物AFD的电子式为________,B2A4的结构式为________.
(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式________;分子中C、F原子间的化学键的类型为________(填“极性键”或“非极性键”),X与水反应的化学方程式为________.
(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为________,Y的硬度比金刚石硬度大的原因是________.
查看答案和解析>>
科目: 来源:福建省泉州一中2011届高三上学期期末考试化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省泉州一中2011届高三上学期期末考试化学试题 题型:022
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体.M的溶液显浅绿色.
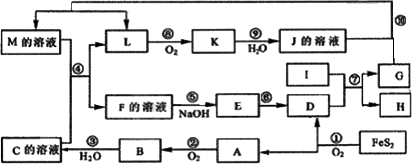
请填写下来空白:
(1)M的化学式________,I的原子结构示意图________,在周期表中,在周期表中,组成单质G的元素位于第________周期第________族.
(2)M中阳离子如何检验________________
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是________(填写序号)
(4)反应④的离子方程式是:________
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.写出该反应的化学方程式并标明电子转移数目和方向:________
(6)每生成1 mol气态B,反应放出98.3 kJ热量,该反应的热化学方程式为________.
查看答案和解析>>
科目: 来源:上海市吴淞中学2011届高三上学期第二次月考化学试题 题型:022
现有NaOH和NaAlO2固体混合物样品若干克,往其中逐滴加入50.00 ml稀H2SO4.
(1)写出可能发生反应的离子方程式(按反应的先后顺序).
________、________、________.
(2)若样品质量为1.22克,产生沉淀0.78克,并得到PH=7的溶液,则样品中①NaOH和NaAlO2的物质的量之比为________;②硫酸的物质的量浓度为________mol/L.
(3)若样品质量为2.44克,与50.00 ml该稀H2SO4反应时,有无沉淀生成?________;若样品质量为0.488克,与50.00 ml该稀H2SO4反应时,有无沉淀生成?________.
(4)若样品质量为a克,与50.00 ml该稀H2SO4反应时,试分析生成沉淀的质量.
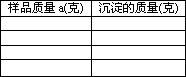
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com