
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期末考试化学试题 题型:022
[化学选修-有机化学基础]
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物.已知:
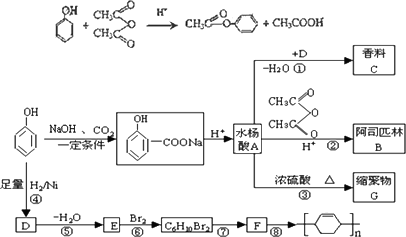
(1)写出反应类型:④________,⑦________.
(2)写出浓硫酸催化条件下,香料C的结构简式________,G的结构简式________.
(3)写出反应②的化学方程式________.
(4)写出反应⑧的化学方程式________.
(5)下列可检验阿司匹林样品中混有水杨酸的试剂是________.
(a)三氯化铁溶液
(b)碳酸氢钠溶液
(c)石蕊试液
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期末考试化学试题 题型:022
[化学选修-物质结构与性质]
(1).CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为________,与CO互为等电子体的离子为________(填化学式).
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.Ti元素在元素周期表中的位置是________周期,第________族;其基态原子的价电子层排布为________;
(3).在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是________;

(4).已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() .
.
则绿色晶体配合物的化学式为________,绿色晶体中含有化学键类型是________.
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期末考试化学试题 题型:022
(1).
下列有关电化学的图示中,完全正确的是________
(2).
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中可与碘化物作用生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.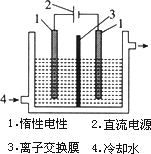
请回答下列问题:
a.碘是________(填颜色)固体物质,实验室常用________方法来分离提纯含有少量泥沙杂质的固体碘.
b.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH![]() 5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
电解时,阳极上发生反应的电极反应式为________,每生成1 mol KIO3,电路中通过的电子的物质的量为________.
c.电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的简单实验方案,并按要求填写下表.
![]()
可供选择的试剂有淀粉溶液,稀硫酸,氯化钠溶液,酒精等.(用其中的一种或多种均可.)
d.电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是________,步骤⑤的操作名称是________.步骤④洗涤晶体的目的是________.
查看答案和解析>>
科目: 来源:黑龙江省大庆铁人中学2011届高三上学期期末考试化学试题 题型:022
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O![]() 、C2O
、C2O![]() ,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:

(1)图中曲线1表示________的分布系数变化;曲线3表示________的分布系数变化.
现有物质的量浓度均为0.1 mol/L的下列溶液:
①Na2C2O4
②NaHC2O4
③H2C2O4
④(NH4)2C2O4
⑤NH4HC2O4
已知NaHC2O4溶液显酸性.
(2)Na2C2O4溶液中,c(Na+)/c(C2O![]() )________2(填“>”、“=”、“<”),原因是________(用离子方程式表示).
)________2(填“>”、“=”、“<”),原因是________(用离子方程式表示).
(3)常温下,向10 mL 0.1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )时,溶液显________性(填“酸”、“碱”或“中”),且V(NaOH)________10 mL(填“>”、“=”或“<”).
)时,溶液显________性(填“酸”、“碱”或“中”),且V(NaOH)________10 mL(填“>”、“=”或“<”).
(4)下列关于五种溶液的说法中,正确的是
A.
溶液②中,c(C2OB.
溶液②中,c(H2C2O4)+c(OH-)=c(C2OC.溶液④⑤中都符合c(NH![]() )+c(H+)=c(HC2O
)+c(H+)=c(HC2O![]() )+2c(C2O
)+2c(C2O![]() )+c(OH-)
)+c(OH-)
D.五种溶液都符合c(H2C2O4)+c(HC2O![]() )+c(C2O
)+c(C2O![]() )=0.1 mol·L-1.
)=0.1 mol·L-1.
(5)五种溶液中c(H2C2O4)
由大到小排列的顺序是________.(6)
配平氧化还原反应方程式:![]()
(7)
称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液.量取两份此溶液各25 mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH溶液至20 mL时,溶液由无色变为浅红色.第二份溶液用0.10 mol/L酸性KMnO4溶液滴定,滴定终点如何判断________.当加入16 mL 0.10 mol/L酸性KMnO4溶液时恰好反应完全.则原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________.如果用0.25 mol/L NaOH溶液滴定第一份溶液的实验滴定终点仰视读数则测得的KHC2O4的质量分数________(填“偏高”“偏低”或“无影响”)查看答案和解析>>
科目: 来源:安徽省合肥市2011届高三第一次教学质检化学试题 题型:022
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:
![]()
它可以分为两步,反应分别如下:
![]()
![]() ________
________
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速和CO的转化率的是________(填字母代号).
a.
降低温度b.
加人催化剂c.
缩小容器体积d.
增加H2的浓度e.
增加CO的浓度(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.问:
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.问:
①反应开始时正、逆反应速率的大小:V(正)________V(逆)(填“>”、“<”或“=”),理由是:________________
②平衡时n(CH3OCH3)=________,平衡时CO的转化率=________.
查看答案和解析>>
科目: 来源:安徽省合肥市2011届高三第一次教学质检化学试题 题型:022
有关元素
X、Y、Z、W的信息如下:
请回答下列问题:
(1)Y的单质在空气中充分燃烧所得氧化物的电子式________;
(2)X
、Y、W的简单离子的半径由大到小的是________(写离子符号);(3)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为___________,Z3+基态离子的电子排布式为________;
(4)以WX3溶液为原料制取无水WX3,主要操作包括加热浓缩、冷却结晶、过滤,先制得WX3·6H2O晶体,然后在条件下加热WX3·6H2O晶体,能进一步制取无水WX3.其原因是(结合离子方程式简要说明)________________.
查看答案和解析>>
科目: 来源:上海市闵行区2011届高三上学期质量调研考试化学试题 题型:022
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:上海市长宁区2011届高三上学期期末质量调研化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:上海市崇明县2011届高三上学期期末考试化学试题 题型:022
已知:
RCHO+CH2(COOH)2RCH=C(COOH)2![]() RCH=CHCOOH+CO2
RCH=CHCOOH+CO2
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)

A的相对分子质量是104,1 mol A与足量NaHCO3溶液反应生成2 mol气体.
(1)A的分子式是________,阿魏酸的结构简式为________
__________.(2)B可能发生的反应是________(填序号)
a、氧化反应 b、水解反应 c、加成反应 d、酯化反应
(3)等物质的量C分别与足量的Na、NaHCO3、NaOH反应时消耗Na、NaHCO3、NaOH的物质的量之比是________.
(4)反应①的化学方程式为________.
(5)写出符合下列条件的阿魏酸所有的同分异构体的结构简式:________
______.①在苯环上只有两个取代基
②在苯环上的一氯取代物只有两种
③1 mol该同分异构体与足量NaHCO3反应生成2 mol CO2气体.
查看答案和解析>>
科目: 来源:浙江省宁波市2011届高三上学期期末试题化学试题 题型:022
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759 g·L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):
![]()
其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
(1)写出化合物甲的电子式:
________.(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式
________;写出均含有F元素的乙与丁在溶液中发生反应的离子方程式
________.(3)由A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34.其中戊的熔沸点高于己,其原因是:
________.(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式
________.该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体.写出相关反应的化学方程式________,析出该复盐晶体的原理是________.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com