
科目: 来源:广东省佛山市2011届高三一模理综化学试题 题型:022
德国化学家列培是乙炔高压化学的开拓者,他发现了一系列乙炔的高压反应(被称为列培反应),为有机合成工业作出了巨大的贡献.
(1)部分列培反应的原理如下(条件从略):
R2NH+HC≡CH→R2NCH=CH2等
(2)列培反应的应用:
高聚物D用途十分广泛,涉及到化妆品乳化剂、染料的分散剂,酒类的澄清剂等,合成流程图如下.试完成以下问题:

①A的分子式是________.
②写出能发生银镜反应的A的直链同分异构体E的结构简式________,有关E的性质的说法正确的是________.
a.能使酸性高锰酸钾溶液褪色
b.能够发生酯化反应
c.一定条件下能与氢气发生加成反应
d.能与金属钠发生置换反应
③Ⅲ的反应类型是________方程式是________(不需写反应条件)
④B的结构简式是________.
查看答案和解析>>
科目: 来源:北京市西城区2011届高三一模理综化学试题 题型:022
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1∶1和1∶2的两种离子化合物.
(1)W在元素周期表中的位置是________,Z2Y的电子式是________.
(2)工业合成XQ3是放热反应.下列措施中,既能加快反应速率,又能提高原料转化率的是________.
a.升高温度
b.加入催化剂
c.将XQ3及时分离出去
d.增大反应体系的压强
(3)2.24 L(标准状况)XQ3被200 mL 1 mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是________.
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是________.
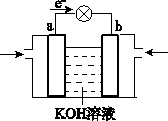
(5)已知:W(s)+Y2(g)=WY2(g) ΔH=-393.5 kJ/mol
WY(g)+![]() Y2(g)=WY2(g) ΔH=-283.0 kJ/mol
Y2(g)=WY2(g) ΔH=-283.0 kJ/mol
24 g W与一定量的Y2反应,放出热量362.5 kJ,所得产
物的物质的量之比是________.
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是________.
查看答案和解析>>
科目: 来源:北京市延庆县2011届高三一模理综化学试题 题型:022
A、B、C、D、E五种短周期元素,原子序数依次增大.A元素的单质是自然界最轻的气体,E单质须保存在煤油中.A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为________;M分子中含有________(填“极性”或“非极性”)键.
(2)D与E以1∶1形成的化合物与水反应的化学反应方程式________.
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式________.
反应后水溶液显________(填“酸”“碱”或“中”)性,原因是____________(用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质.则其负极反应为________;一段时间后,溶液pH________(填“增大”“减小”或“不变”).
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的![]() 平均速率为________;该温度下的平衡常数为K=________.
平均速率为________;该温度下的平衡常数为K=________.
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是________(选填序号字母).
a、及时分离出生成物
b、平衡后再加入6 mol A物质
c、增大压强
d、使用催化剂
e、平衡后再加入2 mol C物质
查看答案和解析>>
科目: 来源:北京市延庆县2011届高三一模理综化学试题 题型:022
分子式为C12H14O2的F有机物广泛用于香精的调香剂.为了合成该物质,某实验室的科技人员设计了下列合成路线:
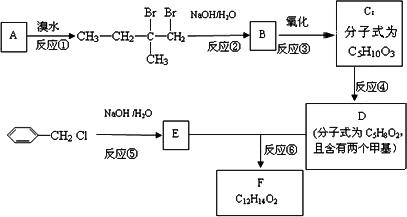
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现________种峰;峰面积比为________.
(2)C物质的官能团名称________.
(3)上述合成路线中属于取代反应的是________(填编号);
(4)写出反应④、⑤、⑥的化学方程式:④________ ⑤________ ⑥________.
(5)F有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3;________________.
查看答案和解析>>
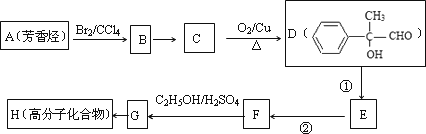
科目: 来源:北京市丰台区2011届高三一模理综化学试题 题型:022
有机物A为羊肉的特征香成分.其合成路线如下:
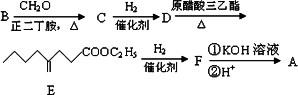
已知:①
②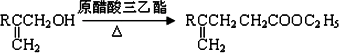
(1)B是烃的含氧衍生物,质谱表明B的相对分子质量为100,其中含氧元素的质量分数为16%.B能发生银镜反应,且分子结构中只有一个-CH3.B中含氧官能团的名称为________;B的结构简式为________.
(2)D能发生的化学反应类型有________(填序号).
①酯化反应
②加成反应
③消去反应
④聚合反应
(3)下列关于E的说法中正确的是________(填序号)
①E存在顺反异构
②能使溴的四氯化碳溶液褪色
③能发生水解反应
④分子式为C11H20O2
(4)写出B→C的化学方程式:________.
(5)写出酸性条件下F→A的化学方程式:________.
(6)若用系统命名法给A命名,A的名称为________.
(7)与C含有相同官能团,分子结构中含有两个-CH3,一个![]() 的同分异构体有________种.
的同分异构体有________种.
(8)与C含有相同官能团,分子结构中含有一个![]()
查看答案和解析>>
科目: 来源:北京市丰台区2011届高三一模理综化学试题 题型:022
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因________________.
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为________.已知1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(s)+4H2(g)(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①
中和含酸废水工业常用的试剂x是________.②写出H2S气体与足量NaOH溶液反应的化学方程式________.
③铁屑与石墨能形成微型原电池,SO![]() 在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO
在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO![]() 在酸性条件下放电生成H2S的电极反应式:________.
在酸性条件下放电生成H2S的电极反应式:________.
④已知:2
H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-632.8 kJ/molS
O2(g)=S(s)+O2(g) ΔH=+269.8 kJ/molH2S
与O2反应生成SO2和H2O的热化学方程式为________.查看答案和解析>>
科目: 来源:北京市丰台区2011届高三一模理综化学试题 题型:022
高纯六水氯化锶(SrCl2·6H2O)可用于制造高档磁性材料、电解金属钠的助熔剂、高档颜料和液晶玻璃等,具有很高的经济价值.高纯六水氯化锶的制备过程如下:
Ⅰ.将纯水加入烧杯内,搅拌下加入适量工业碳酸锶粉末(含少量Ba、Fe的化合物),制成浆料.
Ⅱ.缓慢加入工业盐酸进行酸化,将固体物质溶解.
Ⅲ.然后喷淋加入适量的硫酸,再加入质量分数为30%的双氧水少许.
Ⅳ.调节pH至8~10,加热至60~70℃,搅拌1 h,过滤,除去残渣.
Ⅴ.滤液加热至沸,继续浓缩至氯化锶质量浓度(溶质质量与溶液体积之比)为x g/L.
请回答:
(1)用电子式表示HCl的形成过程________.
(2)已知Sr为第五周期第ⅡA族元素,则不符合Sr>Ca的是________(填序号).
①原子半径
②最外层电子数
③金属性
④最高价氧化物对应的水化物的碱性
(3)写出步骤Ⅱ中加入盐酸时发生反应的离子方程式:________.
(4)加入硫酸后会先生成硫酸锶沉淀,进而转化为硫酸钡沉淀,试分析原理________________.
(5)步骤Ⅲ中在酸性环境下加入双氧水是为将亚铁离子氧化成铁离子,写出该反应的离子方程式:________.
(6)步骤Ⅳ中调节pH至8~10,最好选用的试剂为________.
(7)已知某次实验得到浓缩后的氯化锶溶液中溶质为818 g,溶剂为1000 g,经测定该溶液的密度为1.5 g/mL,则该溶液溶质的质量浓度x为________g/L(计算结果保留整数).
查看答案和解析>>
科目: 来源:北京市东城区2011届高三一模理综化学试题 题型:022
迷迭香酸是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效.某同学设计了迷迭香酸 的合成线路如图所示:
的合成线路如图所示:
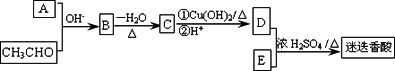
已知:①RCH2CHO+![]() CH2CHO
CH2CHO![]()
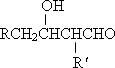
![]() RCH2CH=
RCH2CH=![]() ,R、
,R、![]() 表示烃基或氢原子;
表示烃基或氢原子;
②苯环上的羟基很难直接与羧酸发生酯化反应.
(1)迷迭香酸分子中所含官能团的名称是羟基、羧基、________和________.
(2)迷迭香酸在无机酸作用下发生水解的化学方程式是________.
(3)A的结构简式是________.
(4)E在一定条件下发生缩聚反应的化学方程式是________.
(5)与E互为同分异构体且同时满足下列条件的有机物有________种,写出其中任意两种同分异构体的结构简式:________、________.
①苯环上共有四个取代基,且苯环上只有一种化学环境的氢原子;
②1 mol该同分异构体分别与NaHCO3、NaOH反应时,最多消耗NaHCO3、NaOH的物质的量分别是1 mol、4 mol.
查看答案和解析>>
科目: 来源:上海市杨浦区2011届高三一模化学试题 题型:022
芳香族化合物
X,是一种常用的食用香精.已知X的相对分子质量小于200,X能水解,完全燃烧只生成CO2和H2O,且X分子中碳和氢元素总的质量百分含量约为81.8%.(1)X的分子式是________.
(2)G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:
①
写出A和C的结构简式.A________ C________.②B→C的反应类型是________反应,发生该反应的反应条件是
________.③E→F的反应类型是________反应,该反应的化学方程式为
________.④G→H的化学方程式
________.(3)写出所有符合下列条件的D的同分异构体的结构简式.
分子内除了苯环无其他环状结构,且苯环上有2个对位取代基,其中一个取代基为甲基,另一取代基是含有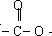 的基团.符合上述条件的D的同分异构体有:
的基团.符合上述条件的D的同分异构体有:
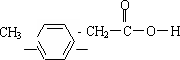 、________.
、________.
查看答案和解析>>
科目: 来源:上海市杨浦区2011届高三一模化学试题 题型:022
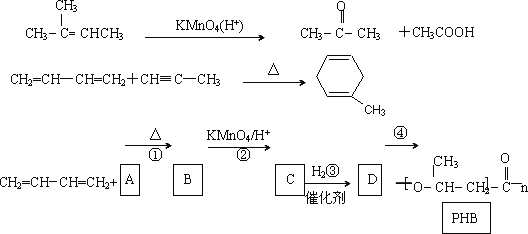
1,3-丁二烯是非常重要的有机化工原料.以下是合成PHB(一种可降解的塑料)的路线.
已知
:
完成下列填空:
(1)写出C的结构简式:________.反应④的反应条件________.
(2)上述转化过程中属于加成反应的是________(填序号)
(3)反应②符合绿色化学思想(碳原子的利用率为100%),则A的结构简式为:________.
(4)核磁共振氢谱可以确定有机物分子中不同化学环境氢原子的种类.例如,核磁共振氢谱表明CH3CH2OH中有三种不同化学环境的氢原子.
物质C有一同分异构体,能发生银镜反应,且核磁共振氢谱表明该化合物只有两种不同化学环境的氢原子,写出该化合物的结构简式:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com