
科目: 来源:黑龙江省鸡西市第一中学2011届高三第二次模拟考试化学试题 题型:022
[化学——选修物质结构与性质]
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为________.(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是________.
(3)A的最高价氧化物对应的水化物分子中其中心原子采取________杂化,E的最高价氧化物分子的空间构型是________.
(4)F的核外电子排布式是________,F的高价离子与A的简单氢化物形成的配离子的化学式为________.
(5)A、F形成某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为________;(每个球均表示1个原子)
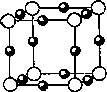
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为________,其晶体中所含的化学键类型为________.
查看答案和解析>>
科目: 来源:山东省莱州市第一中学2011届高三第二次质量检测化学试题 题型:022
Ⅰ.某无色溶液X,由K+、NH![]() 、Ba2+、Al3+、Fe3+、CO
、Ba2+、Al3+、Fe3+、CO![]() 、SO
、SO![]() 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验:
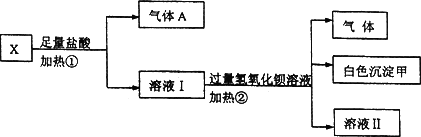
(1)白色沉淀甲是________.
(2)试写出实验过程中生成气体A、B的离子方程式________、________.
(3)通过上述实验,可确定X溶液中一定存在的离子是________,要确定可能存在的离子,需补加的实验是________.
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极.
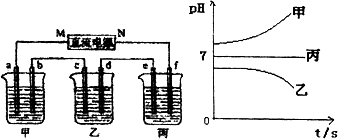
接通电源,经过一段时间后,测得乙中c电极质量增加了16 g.常温下各烧杯中溶液的pH与电解时间t的关系图如上.据此回答下列问题:
(1)M为电源的________极(填写“正”或“负”)电极b上发生的电极反应为________.
(2)计算电极e上生成的气体在标准状况下的体积________;
(3)写出乙烧杯的电解池反应________.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
________
(5)若经过一段时间后,测得乙中c电极质量增加了16 g,要使丙恢复到原来的状态,操作是________.
查看答案和解析>>
科目: 来源:山东省莱州市第一中学2011届高三第二次质量检测化学试题 题型:022
工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)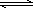 CH3OH(g)ΔH,下表是该反应在不同温度下的化学平衡常数(K):
CH3OH(g)ΔH,下表是该反应在不同温度下的化学平衡常数(K):
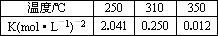
(1)由表中数据判断ΔH________0(填“>”、“=”或“<”).
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5 mol·L-1,则此时的温度为________℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
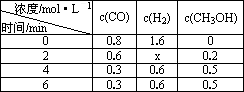
①反应从2 min到4 min之间,H2的反应速率为________.
②反应达到平衡时CO的转化率为________.
③反应在第2 min时改变了反应条件,改变的条件可能是________(填序号).
a.使用催化剂
b.降低温度
c.增加H2的浓度
(4)常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳.该电池的负极反应式为:________.
若以上述燃料电池为电源来电解饱和食盐水,当消耗32 g甲醇时,电解产生的H2体积(标况)为________L.
查看答案和解析>>
科目: 来源:山东省莱州市第一中学2011届高三第二次质量检测化学试题 题型:022
Ⅰ.反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X.
(1)已知K2S在反应中失去电子,则该反应的氧化剂是________.
(2)已知0.5 mol K2S在反应中失去1 mol电子生成X,则X的化学式为________.
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目:
(4)若反应中浓H2SO4过量,则________产物中无X生成,请完成此化学反应方程式:________.
Ⅱ.短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1∶1的离子化合物A,X与Z能形成原子个数比为1∶1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
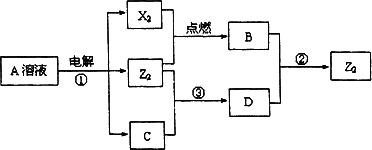
(1)Y在周期表的位置是________;
(2)反应①的化学方程式是________.
(3)D溶液呈碱性的原因是(用离子方程式表示)________.
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去).
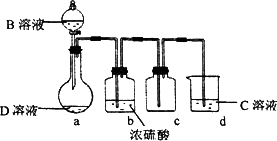
(4)写出反应②的离子方程式________.
(5)上述实验装置不够完善,改进方法是________.
查看答案和解析>>
科目: 来源:江苏省南京市白下区2011届高三二模化学试题 题型:022
替米呱隆(Timiperone)主要用于治疗精神分裂症.其合成路线如下:
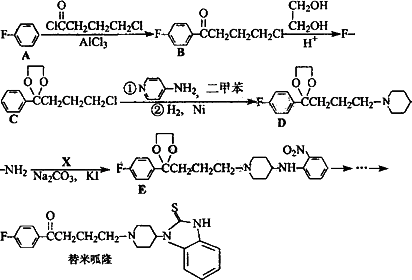
(1)A→B的反应类型为________.
(2)B→化学方程式为________,将B转化为C的目的是________________.
(3)由D制备反应中要加入试剂X(C6H4NO2Cl),X的结构简式为________
(4)C在一定条件下反应可以得到G(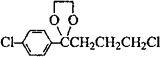 ),符合下列条件的G的同分异构体共有________种(不考虑立体异构).
),符合下列条件的G的同分异构体共有________种(不考虑立体异构).
a.苯环上共有4个取代基,其中有2个处于间位的-CH2Cl取代基;
b.苯环上的一氯取代产物只有1种;
c.能与FeCl3溶液发生显色反应;
d.能发生银镜反应.
(5)已知:
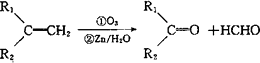
写出由B制备高分子化台物的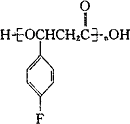 合成路线流程图(无机试剂任选).
合成路线流程图(无机试剂任选).
合成路线流程图示例如下:
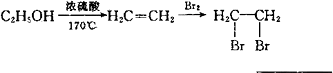
查看答案和解析>>
科目: 来源:广东省潮州市2011届高三二模理综化学试题 题型:022
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途.干法、湿法制备高铁酸盐的原理如下表所示.

(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
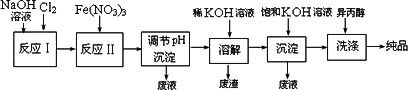
①反应Ⅰ的离子方程式为
________.②反应Ⅱ的化学方程式为
________.③加入饱和KOH溶液的目的是
________________.(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为
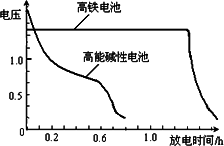
________,它能净水的原因是________________.(4)高铁电池是正在研制中的可充电干电池,下图为高铁电池和常用的高能碱性电池的放电曲线,由图可得出高铁电池的优点有:工作电压稳定,
________.
查看答案和解析>>
科目: 来源:广东省潮州市2011届高三二模理综化学试题 题型:022
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能.也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.请填写下列空白:
(1)二甲醚、空气、氢氧化钾溶液多孔石墨电极可构成燃料电池.该电池中负极的电极反应式是:CH3OCH3+16OH--12e-=2CO
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH=a kJ·mol-1
CH3OH(g) ΔH=a kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=b kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=b kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
总反应
:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=________kJ·mol-1.
CH3OCH3(g)+CO2(g)的ΔH=________kJ·mol-1.
(3)
已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
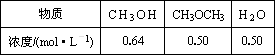
①比较此时正、逆反应速率的大小:v(正)________v(逆)(填“>”、“<”或“=”),简述原因
________________.②若开始只加入CH3OH,经10 min后反应达到平衡,平衡时CH3OH转化率α(CH3OH)=________(计算结果保留小数后一位).
查看答案和解析>>
科目: 来源:广东省潮州市2011届高三二模理综化学试题 题型:022
从有机物A开始有如图所示的转化关系(部分产物略去).A在NaOH溶液中水解生成B、C和D,1 mol F与足量的新制Cu(OH)2碱性悬浊液加热充分反应可生成2 mol红色沉淀.分析并回答问题:

(1)A中含有的官能团为氯原子(-Cl
)和________、________.(2)指出反应类型:
A![]() B
B
(3)写出下列反应的化学方程式:
①C![]() F
F
②E![]() H:
H:
查看答案和解析>>
科目: 来源:安徽省江南十校2011届高三二模冲刺卷理综化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:安徽省江南十校2011届高三二模冲刺卷理综化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com