
科目: 来源:辽宁省抚顺市六校联合体2011届高三一模考试化学试题 题型:022
已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D为无色无味气体,无色气体G遇空气变红棕色.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如下图(部分反应产物已略去).
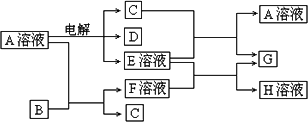
请回答下列问题:
1.A的化学式为________.
2.A溶液与Na2O2反应的总化学方程式为________.
3.E的稀溶液与F溶液反应的离子方程式为________.
4.电解100 mL盐A的溶液一段时间后,断开电路,取出电极,测得所得到的气体D在标准状况下的体积为5.6 mL,则电解后溶液的pH为________.(假设溶液体积不变)
5.若向100 mL盐A的溶液中加入10 g金属单质B的粉末,充分搅拌后,过滤,烘干得10.16 g固体,则滤液中溶质的物质的量浓度为________.(假设溶液体积不变)
查看答案和解析>>
科目: 来源:2011年普通高等学校招生全国统一考试化学试题江苏卷 题型:022
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为________,1 mol Y2X2含有σ键的数目为________.
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是________.
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是________.
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是________,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为________.
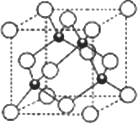
查看答案和解析>>
科目: 来源:2011年普通高等学校招生全国统一考试化学试题江苏卷 题型:022
敌草胺是一种除草剂.它的合成路线如下:

回答下列问题:
(1)在空气中久置,A由无色转变为棕色,其原因是________.
(2)C分子中有2个含氧官能团,分别为________和________填官能团名称).
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:________.
①能与金属钠反应放出H2;②是萘(![]() )的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧.
)的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧.
(4)若C不经提纯,产物敌草胺中将混有少量副产物E(分子式为C23H18O3),E是一种酯.E的结构简式为________.
(5)已知:![]() ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图例如下:
的合成路线流程图(无机试剂任用).合成路线流程图例如下:
![]()
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题8 溶液中的离子平衡 题型:022
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”).
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”).
(2)已知:O2(g) O
O![]() (g)+e- ΔH1=1175.7 kJ·mol-1
(g)+e- ΔH1=1175.7 kJ·mol-1
PtF6(g)+e- PtF(g) ΔH2=-771.1 kJ·mol-1
PtF(g) ΔH2=-771.1 kJ·mol-1
O
 O
O则反应
O2(g)+PtF6(g) O
O(3)
在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.(4)
在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题8 溶液中的离子平衡 题型:022
以下是25℃时几种难溶电解质的溶解度:
![]()
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是________.
(3)②中除去Fe3+所发生的总反应的离子方程式为________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜或氧化铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题8 溶液中的离子平衡 题型:022
A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合.(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
(1)写出化学式:A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为________;
(3)写出0.1 mol/L的A2溶液中离子浓度大小排序________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是________;
(5)常温下,若B1、B2两溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题8 溶液中的离子平衡 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题3 金属及其化合物 题型:022
下图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色.
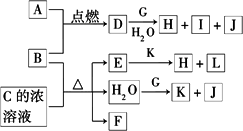
回答下列问题:
(1)K名称为________,所含的化学键有________.
(2)①D的水溶液呈棕黄色,则D的水溶液与G反应的离子方程式为________.
②少量B与C的浓溶液加热时反应的化学方程式为________.
(3)①若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的下列关系式为________(填代号).
A.c(Na+)+c(H+)=c(OH-)+c(HSO![]() )+2c(SO
)+2c(SO![]() )
)
B.2c(Na+)=3c(H2SO3)+3c(HSO![]() )+3c(SO
)+3c(SO![]() )
)
C.c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H2SO3)
)>c(H2SO3)
D.c(OH-)>c(H+)
②若将标准状况下2.24 L的F通入150 mL 1 mol·L-1的K溶液中.则所得溶液中各粒子浓度关系满足的上述关系式为________(填代号).
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题3 金属及其化合物 题型:022
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)
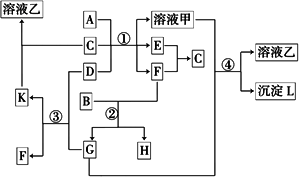
(1)A、B、C、D代表的物质分别为________、________、________、________(填
化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、________(填化学式);
(4)反应③产物中K的化学式为________;
(5)反应④的离子方程式为________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题17 硅及其化合物 题型:022
X、Y、Z为短周期元素的单质,X、Y的组成元素为同主族元素,U、V为它们的化合物,这些物质之间的转化关系如下图所示,其中反应条件和某些产物已经略去.
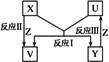
(1)若V是水,则:①X是________、U是________
②由于U有剧毒,工业上产生的U要经过处理变成单质Y后方能排放,以防止大气污染.富玛克斯法治理U的方法和步骤如下:
第一步:用2%~3%的Na2CO3溶液作为吸收剂生成2种酸式盐;
第二步:再加入一种RNO(溶液)(R表示芳香烃基)与生成的一种酸式盐的水溶液反应生成硫、碱和RNHOH;
第三步:第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
第四步:RNHOH与空气中的氧发生反应又得到RNO.
则:第一步反应的化学方程式为________.
总反应的化学方程式为:________.
请对富玛克斯法的优点做一简要评价:________.
(2)若U、V均为氧化物,则:
①写出反应Ⅰ的化学方程式:________.
②计算机长距离联网使用的传输速度快、信息量大的线路,使用的材料的主要化学成分是U,该材料的名称是:________.
③这种材料埋在地下时,如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com