
科目: 来源:山东省枣庄十八中2012届高三9月月考化学试题 题型:022
工业制硫酸的核心反应是:2SO2(g)+O2(g)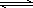 2SO3(g) △H<0,回答下列问题:
2SO3(g) △H<0,回答下列问题:
(1)此反应的平衡常数表达式为K=________,随着温度的升高,上述平衡常数________(填“增大”、“减小”或“不变”).
(2)将一定量的SO2(g)和O2(g)放入1 L密闭容器中,在一定条件下达到平衡,测得SO2为0.11 mol,O2为0.05 mol,SO3为0.12 mol.计算该条件下,反应的平衡常数K=________.
SO2的转化为SO3转化率=________.
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是________
(填字母).
A.通入氧气
B.移出氧气
C.增大压强
D.减小压强
E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2,可先用氨水吸收,再用硫酸处理.
①反应的化学方程式为________,
②这样处理的优点是________.
查看答案和解析>>
科目: 来源:吉林省长春市十一高中2012届高三上学期期初考试化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第一次考试化学试题 题型:022
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.
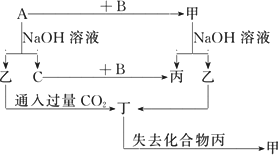
根据图示转化关系回答:
(1)写出下列物质的化学式:
A________,B________,乙________,丁________
.(2)组成单质A的元素在周期表中的位置是________,工业上制备A物质的化学反方程式是________.
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式________.
②乙与过量CO2反应的离子方程式________
.查看答案和解析>>
科目: 来源:河北省唐山一中2012届高三上学期第一次调研考试化学试题 题型:022
X、Y、Z、E和F分别代表原子序数依次增大的五种短周期元素,它们满足以下条件:
①Z元素的原子半径是短周期元素中除稀有气体外半径最大的;
②X与Z同主族,Y与F同主族;
③X与F可组成化学式为X2F的共价化合物;
④Z和E二者的最高价氧化物对应的水化物之间能发生反应.
请填空:
(1)写出F元素在元素周期表中的位置________
(2)X和Y可形成电子数相等的两种粒子,该两种粒子反应后生成一种中性分子,反应的离子方程式是________.
(3)写出单质E与Z的最高价氧化物的水化物反应的离子方程式:________.
(4)均含有X、Y、Z和F四种元素的两种化合物在溶液中发生反应的离子方程式
________.
查看答案和解析>>
科目: 来源:安徽省阜阳一中2012届高三第一次月考化学试题 题型:022
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
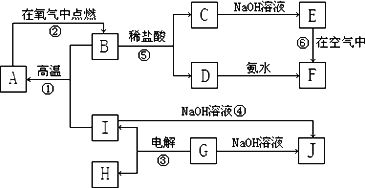
(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置________.
(2)写出C、G物质的化学式:C________G________
(3)写出①、④、⑥反应的化学反应方程式.
反应①________
反应④________
反应⑥________
(4)写出A与水蒸气反应的化学反应方程式________
查看答案和解析>>
科目: 来源:江苏省无锡一中2012届高三9月初检测试题化学试题 题型:022
下表为长式周期表的一部分,其中的编号代表对应的元素.试填空.
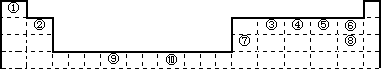
(1)写出上表中元素⑨原子的外围电子排布式________.
(2)元素③与⑧形成的化合物中元素③的杂化方式为:________杂化,其形成的化合物的晶体类型是:________.
(3)元素④、⑤的第一电离能大小顺序是:________>________(用元素符号表示);元素④与元素①形成的X分子的空间构型为:________.请写出与N3-互为等电子体的分子或离子的化学式________,________(各写一种).
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:________.
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应的化学方程式________.
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:________.

查看答案和解析>>
科目: 来源:江苏省无锡一中2012届高三9月初检测试题化学试题 题型:022
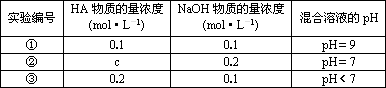
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从第①组情况分析,HA是强酸还是弱酸________.该组所得混合溶液中由水电离出的c(OH-)=________mol·L-1.
(2)第②组情况表明,c________0.2(选填“大于”、“小于”或“等于”).该混合液中离子浓度c(A-)与c(Na+)的大小关系是________.
(3)从第③组实验结果分析,说明此时HA的电离程度________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中各离子浓度由大到小的顺序是________.
(4)由上述所涉及的溶质组成以下四组等体积溶液:
甲:0.1 mol/L NaA;
乙:0.1 mol/L NaA和0.1 mol/L HA;
丙:0.1 mol/L HA;
丁:0.1 mol/L NaA和0.1 mol/L NaOH;
则A-离子浓度由大到小的顺序为________>________>________>________.(填写序号)
查看答案和解析>>
科目: 来源:山东省实验中学2012届高三第一次诊断性考试化学试题 题型:022
将水煤气化转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域.除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气.
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应.
CO(g)+H2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为________;
②下列能增大碳的转化率的措施是________;
A.加入C(s)
B.加入H2O(g)
C.升高温度
D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+3/2O2(g)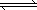 CO(g)+2H2O(g) ΔH=-519 kJ/mol.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g)+2H2O(g) ΔH=-519 kJ/mol.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是________(填“X”或“Y”或“Z”),选择的理由是________;
(3)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:
2H2(g)+CO(g)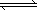 CH3OHg);ΔH=-90.8 kJ·mol-1,T℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如下:
CH3OHg);ΔH=-90.8 kJ·mol-1,T℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如下:
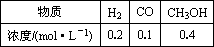
①该时间段内反应速率v(H2)=________mol-1·L-1·min-1.
②比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是________.
查看答案和解析>>
科目: 来源:陕西省西安铁一中2011届高三第二次模拟考试化学试题 题型:022
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.
单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:

(1)某同学根据上述信息,推断B的核外电子排布如图所示,

该同学所画的电子排布图违背了________.
(2)根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为________.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45 pm,C60中C-C键长为145~140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确________,并阐述理由________.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.写出基态钾原子的电子排布式________,该物质的K原子和C60分子的个数比为________.

(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是________.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为________.
查看答案和解析>>
科目: 来源:湖北省武汉市部分学校2011-2012学年高三新起点调研测试化学试题 题型:022
钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TIO2),TiO2常通过两种方法可制得Ti.
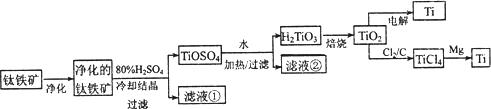
其中
,2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.回答下列问题.(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH Na2SiO3+H2O
Na2SiO3+H2O
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是:________.
(3)从TiOSO4→H2TiO3需要加热,则加热的目的是:________.
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.其阴极反应的电极反应式为:________.
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应TIO2(s)+2C12(g) TICl4(l)+O2(g)顺利进行的原因是:________.
TICl4(l)+O2(g)顺利进行的原因是:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com