
科目: 来源:江西省临川一中、新余四中2012届高三上学期期中考试化学试题 题型:022
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g);ΔH=a kJ·mol-1
2NO(g);ΔH=a kJ·mol-1
![]()
①该反应的△H________0
(填“>”、“=”或“<”).②其他条件相同时,在上述三个温度下分别发生该反应.
1538℃时,N2的转化率随时间变化如图所示,
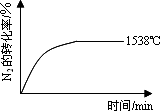
请补充完成1760℃时N2的转化率随时间变化的示意图.
(2)2404℃
时,在容积为1.0 L的密闭容器中通入2.6 mol N2和2.6 mol O2,计算反应N2(g)+O2(g)(3)
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.相应的热化学方程式如下:2N2(g)+6H2O(1)=4NH3(g)+3O2(g);ΔH=+1530 kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热ΔH=________.(用含a的代数式表示)
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2![]() 2NH3.则在电解法合成氨的过程中,
2NH3.则在电解法合成氨的过程中,
查看答案和解析>>
科目: 来源:山东省济宁市金乡二中2012届高三11月月考化学试题 题型:022
中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是________,该反应的化学方程式是________.
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是________.
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是________(填所在周期和族);Y的化学式是________.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是________mol.
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1∶4恰好反应后,该反应的化学方程式是________.
查看答案和解析>>
科目: 来源:河北省冀州中学2012届高三上学期期中考试化学试题(A) 题型:022
(Ⅰ)有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:

请根据上图推断:
(1)原溶液中一定存在的离子有________.
(2)写出实验④中沉淀量由A→B过程中所发生反应的离子方程式:________.
(3)实验③中产生无色无味气体所发生的化学方程式为:________.
(Ⅱ)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(4)该反应中,化合价升高的反应物是________.
(5)写出一个包含上述七种物质的氧化还原反应方程式:________.
(6)上述反应中,1 mol氧化剂在反应中得到电子的数目为________.
(7)下图:将浓盐酸滴入高锰酸钾固体中,制取适量黄绿色气体的简易装置,请回答装置B、C、D的作用分别是:
B________;C________;D________.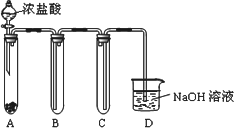
查看答案和解析>>
科目: 来源:山西省太原市2012届高三第一学段测评考试化学试题 题型:022
[选修5-有机化学基础]
A、B、C、D均为有机化合物.请根据以下框图,回答问题:
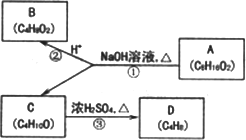
(1)B不含有支链,则B的结构简式为________,其中含有的官能团是________.
(2)C含有支链,在浓硫酸作用下加热反应只能生成一种烯烃D(不考虑立体异构),则D的结构简式为________,其名称(系统命名)是________.
(3)C在催化剂Cu的作用下被氧气氧化为有机物E,E能发生银镜反应,则C的结构简式为________.
(4)写出反应①的化学方程式:________,其反应类型是________.
(5)物质B有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:________.
ⅰ)既能发生银镜反应,又能发生水解反应
ⅱ)其核磁共振氢谱有三种类型氢原子的吸收峰
查看答案和解析>>
科目: 来源:山西省太原市2012届高三第一学段测评考试化学试题 题型:022
[选修3-物质结构与性质]
A、B、C、D、E为五种短周期元素,且原子序数依次增大.其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数.C原子的最外层中有两个不成对的电子.D、E的原子核内各自的质子数与中子数相等.C可分别与A、B、D、E形成XC2型化合物(X代表A、B、D、E中的一种元素).已知在DC2和EC2中,D与C的质量之比为7∶8;E与C的质量之比为1∶1.请回答下列问题:
(1)基态D原子的电子排布式为________,单质B2中σ键与π键的数目之比为________.
(2)化合物BH3(H代表氢元素)的立体构型为________,B原子的杂化轨道类型是________.
(3)C和E的最简单氢化物分别为甲和乙,请比较相同条件下甲、乙的沸点大小,并说明理________.
(4)A可以形成多种结构不同的单质,其中M是所有已知晶体中硬度最大的,其晶体类型是________;若该晶体晶胞(如图所示)的边长为a cm,则其密度是________g·cm-3(只要求列式,不必计算出数值,阿伏加德罗常数为NA).
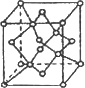
查看答案和解析>>
科目: 来源:山西省太原市2012届高三第一学段测评考试化学试题 题型:022
如下图所示的转化关系中,已知A是由短周期元素组成的酸式盐.通常状况下,D、E、F、Y、H为气体.G和K均为常见的强酸,D和X的分子中均含有10个电子.请回答下列问题:
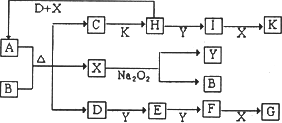
(1)B的电子式为________,其中含有的化学键类型是________;C的化学式是________.
(2)写出在加热条件下.A与足量的B溶液反应的离子方程式:________.
(3)写出D与Y在点燃条件下反应,生成X和一种单质的化学方程式:________.
(4)若G的稀溶液溶解了a mol Fe后(假设E是唯一的还原产物),溶液中两种金属阳离子的物质的量恰好相等,则被还原的G是________mol(用含a的代数式表示).
查看答案和解析>>
科目: 来源:安徽省师大附中2012届高三第四次模拟考试化学试题 题型:022
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:浙江省杭州高级中学2012届高三第三次月考化学试题 题型:022
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)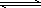 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的ΔH________(填“增大”“减小”或“不改变”).
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的ΔH________(填“增大”“减小”或“不改变”).
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2.已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 kJ·mol-
2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
又知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量.写出CO和水蒸气在高温催化剂下反应的热化学方程式________.
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大.请写出该电池的正极反应式________.
(5)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11.在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则Va∶Vb=________.
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显________性(填“酸”“碱”或“中”);
(7)NH4Cl是一种重要的化肥.
①用0.1 mol·L-1的盐酸滴定0.1 mol·L-1的氨水,滴定过程中不可能出现的结果是:
a.c(NH![]() )=c(Cl-),c(OH-)=c(H+)
)=c(Cl-),c(OH-)=c(H+)
b.c(NH![]() )>c(Cl-),c(OH-)<c(H+)
)>c(Cl-),c(OH-)<c(H+)
c.c(NH![]() )>c(Cl-),c(OH-)>c(H+)
)>c(Cl-),c(OH-)>c(H+)
d.c(NH![]() )<c(Cl-),c(OH-)>c(H+)
)<c(Cl-),c(OH-)>c(H+)
②NH4Cl溶液中存在:NH4++H2O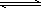 NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10-5 mol·L-1)
NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10-5 mol·L-1)
查看答案和解析>>
科目: 来源:浙江省杭州高级中学2012届高三第三次月考化学试题 题型:022
如图所示,当关闭K时,向A中充入2 mol X、7 mol Y,向B中充入4 mol X、14 mol Y,起始时VA=VB=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)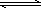 Z(g)+2W(g) ΔH<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g) ΔH<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
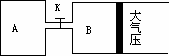
(1)B中X的转化率α(X)B为________
(2)A中W和B中Z的物质的量的比较:n(W)A________n(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,
B的体积为________升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是________.
查看答案和解析>>
科目: 来源:浙江省杭州高级中学2012届高三第三次月考化学试题 题型:022
把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N2H4).

(1)写出上述反应的化学方程式:________
(2)联氨是一种可燃性液体,可用作火箭燃料.已知32.0 g N2H4和H2O2反应生成氮气和水(气态),放出热量642 kJ,该反应的热化学方程式是:________
(3)联氨的水溶液显弱碱性,用离子方程式表示其显弱碱性的原因:________
(4)联氨-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.联氨-空气燃料电池放电生成N2和H2O,其电极反应式是:正极________;负极________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com