
科目: 来源:河南省南阳一中2012届高三上学期第四次考试化学试题 题型:022
已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子的最外层电子数之和.Y与X形成的分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号为:X________、Z________.
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________.
(3)由X、Y、Z所形成的常见离子化合物是(写化学式)________,该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为:________;X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”).
(4)用电子式表示W与Z形成W2Z化合物的过程:________.
查看答案和解析>>
科目: 来源:江苏省南京市四校2012届高三12月月考化学试题 题型:022
草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li
2FeSiO4)等,其制备过程主要包括:a.将硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体溶于适量蒸馏水,加入适量稀硫酸酸化.
b.
将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全.c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干.
试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O
溶液时,需加入少量稀硫酸,目的是________.(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数).
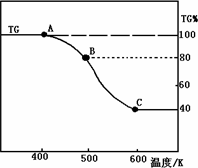
①则A-B发生反应的化学方程式为:________.
②精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式:________、________;
(3)Li2CO3、FeC2O4·2H2O
和SiO2粉末均匀混合,在800℃.的氩气中烧结6小时,即可制成硅酸亚铁锂.①合成硅酸亚铁锂的化学方程式为:________.
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,
写出相应的电极反应式
:正极________、负极
________.查看答案和解析>>
科目: 来源:江苏省南京市四校2012届高三12月月考化学试题 题型:022
CYP73A1炔抑制剂的合成路线如下:
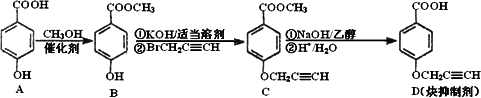
(1)化合物A核磁共振氢谱有________种蜂.
(2)化合物C中含氧官能团有________、________(填名称).
(3)鉴别化合物B和C最适宜的试剂是________.
(4)写出A-B的化学方程式________.
(5)B的同分异构体很多,符合下列条件的异构体有________种.
①苯的衍生物
②含有羧基和羟基
③分子中无甲基
(6)试以苯酚、氯乙酸钠(ClCH2COONa)、正丁醇为原料(无机试剂任用),结合题中有关信息,请补充完整的合成路线流程图.
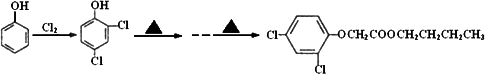
查看答案和解析>>
科目: 来源:江苏省南京市四校2012届高三12月月考化学试题 题型:022
无水
AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下.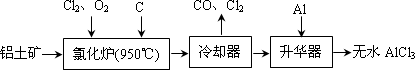
(1)氯化炉中Al2O3、C12和C反应的化学方程式为________.
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为________.
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________.
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g.
①写出除杂过程中涉及的离子方程式________、________.
②AlCl3产品的纯度为________.
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是________.
查看答案和解析>>
科目: 来源:山东省济宁市邹城二中2012届高三第二次质量检测化学试题 题型:022
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大.甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍.在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
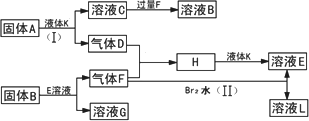
试回答:
(1)甲元素的名称为________,溴元素在周期表的位置________丁元素的阴离子结构示意图为________.
(2)A的电子式为________;所含化学键类型为________.
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示)________.
(4)反应(Ⅰ)的化学方程式为________.
(5)反应(Ⅱ)的离子方程式为________.
查看答案和解析>>
科目: 来源:辽宁省铁岭高级中学2012届高三第一学期期中考试化学试题 题型:022
CO和H2可作为能源和化工原料,应用十分广泛.
(1)已知:C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH2=-483.6 kJ·mol-1
2H2O(g) ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1
则反应
CO(g)+H2(g)+O2(g)标准状况下的煤炭气
(CO、H2)336 L与氧气反应生成CO2和H2O,反应过程中转移________mol电子.(2)
熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的.负极的电极反应式为:CO+H2-4e-+2CO32-(3)
密闭容器中充有1 mol CO与2 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)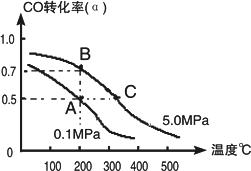
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10 L,则该温度下的平衡常数K=________;此时在B点时容器的体积VB________10 L(填“大于”、“小于”或“等于”).
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tC________tA(填“大于”、“小于”或“等于”).
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是________.(写出两点即可)
查看答案和解析>>
科目: 来源:江西省上饶县中学2012届高三第三次月考化学试题(普) 题型:022
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:甘肃省张掖二中2012届高三9月月考化学试题 题型:022
物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G的浓溶液中发生钝化,F的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明).请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)
回答下列问题:
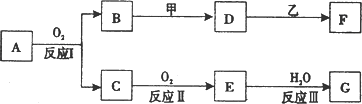
(1)第一种情况:用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质;D和F的溶液均呈碱性.则:
①反应Ⅲ的化学方程式为________.
②D与乙反应的离子方程式为________
(2)第二种情况:甲由两种单质直接化合得到;B为红棕色固体;C为无色气体,是形成酸雨的大气污染物之一;D的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成.则:
①工业上,反应I的化学方程式为________
生产设备名称为:________
②D和乙反应的离子方程式为________
③请简述检验D溶液中阳离子的方法________.
④若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化.现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρ g/cm3,溶质质量分数为a%的G溶液n mL.则该样品中A的质量分数=________(列出计算式即可).
查看答案和解析>>
科目: 来源:浙江省浙南、浙北部分学校2012届高三12月联考化学试题 题型:022
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来.如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:
Cu2++2H2Dz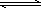 Cu(HDz)2+2H+,
Cu(HDz)2+2H+,
再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中.
(1)写出双硫腙和Fe3+络合的离子方程式:________.萃取过程中要控制适宜的酸度.如果溶液的pH过大,其后果是________.
下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线.它反映了萃取某些金属离子时适宜的pH范围.E%表示某种金属离子以络合物形式被萃取分离的百分率.
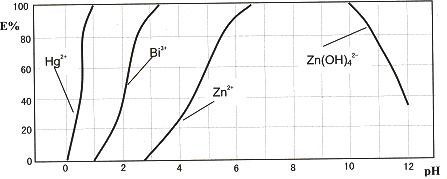
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水.
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=________
(3)当调节pH=2时,铋(Bi)的存在形式有:________,其物质的量之比为________
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中.写出反应的离子方程式:________
查看答案和解析>>
科目: 来源:福建省福州八县(市)一中2012届高三上学期期中联考化学试题 题型:022
(1)
某化学反应可用下式表示:A+B C+D+H2O,若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式:________
C+D+H2O,若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式:________
(2)硝酸铅的稀溶液中,滴入几滴稀Na2SO4生成白色PbSO4沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式①________②________
(3)边微热边向铵明矾[NH4Al(SO4)2`12H2O]溶液中逐滴加入Ba(OH)2溶液至中性
(提示:NH![]() 、Al3+恰好完全反应)
、Al3+恰好完全反应)
①此时发生反应的离子方程式为________
②向以上所得中性溶液中继续滴加稀硫酸,相关反应的离子方程式是:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com